Historic Maple Research Archives
Archive Navigation
Maple Info Main Menu
Part A: History of Maple Syrup and Sugar Production
Part B: The Maple Resource
Jump To: Species Suitable for Maple Production Jump To: Sap Production
Part C: Planning a Maple Syrup Operation
Part D: Managing Maple Trees for Sap Production
Jump To: Sap Sweetness and Sap Yield Jump To: Tree Improvement – General Jump To: Propagation Techniques Jump To: Planting Jump To: Tree Morphology and Physiology Jump To: Testing Sap Sweetness Jump To: Tree Selection and Progeny Testing Jump To: Cultural Practices
Part E: Factors Affecting Maple Health
Jump To: Insects Jump To: Disease – Decay and Stain Jump To: Freeze/Thaw ND Jump To: Sunscald/Exposure ND Jump To: Ice Damage Jump To: Drought ND Jump To: Frost Jump To: Acid Precipitation Jump To: Woodlot Management ND Jump To: Grazing ND Jump To: Soil ND Jump To: Topography ND Jump To: Competing Vegetation ND Jump To: Tree Condition ND Jump To: Stand Condition ND Jump To: Decline Comply Jump To: Global Warming
Part F: Maple Sap Production: Tapping, Collecting, and Storage
Part F has been divided into Subsections
Jump To: Vacuum Systems, Maintaining Sap Quality, Sap Collection Equipment, Economics of Sap Collection, Research, Proper Tubing Installation, Cleaning Equipment, Energy
Vacuum Systems
Maintaining Sap Quality
Sap Collection Equipment
Economics of Sap Collection
Research
Proper Tubing Installation
Cleaning Equipment
Energy
Part G: Syrup Filtration, Grading, Packing, and Handling
Part H: Maple Sugar, Maple Butter, and Other Maple Products
Part I: Economics of Maple Syrup Production and Marketing
Part J: Maple Production and Processing Facilities
Part K: Maple Chemistry and Quality
Part L: Maple Extension Publications
Part M: Executable Software
Part N: Slide Sets, Video Clips, and Sound
Part O: Miscellaneous
Part A: History of Maple Syrup and Sugar Production
The Beginning of the Maple Era
Extension
Maple Syrup Digest
Harold Tyler, Westford, New York
Vol. 20, No. 2
July 1980
REF# 024
As you all know, there was no sweetening agent available except bee honey at the time of settlement of the colonies. Little cane sugar was used as it had to be transported from Asia and was too expensive. It was used only by the rich and for medicinal uses. About the year 1500 sugar cane was grown in Brazil and the West Indies. Sugar from the maple tree was soon discovered. Among the colonist’s one of the first references is dated 1664 when British officials mention sugar from trees in Massachusetts. A letter of 1684 enclosing some maple sugar from Canada, states that the Indians have practiced it time out of mind. An anonymous author of 1685 recorded – the savages have practiced this art longer than any now living among them can remember. Some of the prominent men that promoted maple sugaring were Judge William Cooper (1754-1809), father of the journalist James Fenimore Cooper, who held large acreage around Cooperstown. He distributed potash kettles and bought maple sugar from the early settlers.
Figure 1. 200 year old maple tree in front of the Jefferson Estate.
Tench Coxe, Assistant Secretary of the Treasury under Alexander Hamilton and also grandson of Danial Coxe, who held title to 100,000 acres of land in upstate New York and inherited much of this acreage. At times, Cooper acted as his land agent. Coxe was a great promoter of American Agriculture.
Thomas Jefferson was an ardent advocate of large scale maple sugar manufacture. He tried hard to establish a maple plantation on his Virginia Estate. The trees were taken from New York State and set out there. Some are still alive on the Monticello estate.
I have spent some time in the Jefferson Estate library to try and locate the original site where the maple trees were set, and found out that Jefferson owned a large tract of land near Natural Bridge, Virginia and this is where he set them. I have not located the exact site yet, but hope to next time I visit Virginia. There are several maple operations in Highland County, Virginia operating now.
There are many illusions to the manufacture of maple during the Revolution. In April 1780, for instance, a detail of fourteen men were sent from the Schoharies forts to spy upon activities of suspected loyalists near Harpersfield. While watching, they were ordered to make sugar for the garrison. These men were surprised at their task by Tories and Indians. Some were slain and the rest taken captive to Canada.
Directly after the peace in 1783, the sugar boom began in earnest. Prominent merchants and those with wealth, mostly from Philadelphia, advanced money and supplies for it’s promotion.
In a letter July 10, 1791, to Thomas Jefferson about maple sugaring, the subject was covered thoroughly, enumerating the uses of the tree, the various commodities possible to be made from the sap, the value of the sugar for medicine and as an article of diet, the number of acres of maple trees and yield per acre, and concluded that the nation can save $8,000,000 in imports and have a surplus worth $1,000,000 for export.
The population grew fast and the land was cleared for crops. Cane sugar was obtained easier. In 1891, a bounty of two cents a pound was offered to American sugar producers, both cane and maple. Almost every farm in the late 1800’s and early 1900’s had a maple sugar operation. Today, there are but a few operators left.
There still exists a great potential for its manufacture. It is said, that New York State taps less than 5% of it’s maple trees. It is also stated that if all the maple syrup manufactured in the maple producing areas was divided up among the United States citizens, each would have less than one teaspoonful. Let us take a better look at our existing resources, and put them to use for the betterment of our economy here. Maple sugaring has been an important crop, and still can be more important.
The Great Days of Maple Sugar
Extension
Maple Syrup Digest
Roy L. Butterfield
Vol. 8, No.2
July 1969
REF# 110
For Millenniums before sea routes were established round Africa to the Orient, honey was the sweetening agent available to Europeans. The Bible and other writings of ancient authors abound with references to it. The honeybee came with white men to American shores and spread ahead of settlement along all the frontiers. Both in Europe and in America honey was used more than sugar until colonization here was well advanced. The sugar cane developed somewhere in Asia, India or Malaya and is of great antiquity, but little of the product reached Europe while it was transported by the slow land route passing through many hands. It was expensive, and so used only by the rich, or by the physician as a nourishing prescription. Portuguese brought it by sea around Cape of Good Hope to Lisbon about 1500. Almost at once sugar cane culture was introduced into Brazil and soon spread to the West Indies. With the latter, Boston merchants and ship owners had a lively trade in sugar, molasses and rum before the American Revolution. Sugar from beets, upon which Europe now chiefly depends, was not manufactured at all until 1801, and had no firm hold until about 1830.
Figure 1.
In America a new source for sweetening was found in Acer saccharinum the sugar maple, rock maple or sugar tree. Whether white men acquired the art of maple sugar making from the Indians, or vice versa, has been much debated. The natives made large water tight receptacles by hollowing out logs or from birch bark caulked with pitch, but they had no vessel to withstand placement over direct high heat. So the white man’s metal kettles were highly prized by them, and were a most important item in the earliest Indian trade. After such trade began there is no difference of opinion. Indians then made maple sugar wherever the hard maple grew, and farther to the west were proficient at it when the whites made first contact with them. Lewis H. Morgan, noted Indian ethnologist, wrote in 1851 in his League of the Iroquois: “Our Indian population have been long in the habit of manufacturing sugar from the maple. Whether they learned the art from us, or we received it from them, is uncertain. One evidence of its antiquity is to be found in one of the their ancient religious festivals, instituted to the maple, and called the Maple dance.” Recent writers have been more partisan; Scott Nearing, an able sociologist, has for many years been engaged in the practical manufacture of maple products in Vermont on a considerable scale. The Maple Sugar Book, by Helen and Scott Nearing (1950), is not only a compendium of successful modern methods but a history of the whole industry. One chapter bears the title “Indians, the First Maple Sugar Makers.” Their arguments are powerful and well documented. Jared wan Wagenen, Jr. however, in his Golden Days of Homespun, confesses himself unable to believe that sugar could be made by immersing red hot stones in a vessel of sap, which is the common Indian method described by the early writers. This process could be greatly assisted by first allowing the sap to freeze partly and casting away the ice, which was practically pure water.
A telling point in favor of Indian primacy is that the earliest records mention Indians, not whites, engaged in this manufacture. A letter of 1684, enclosing some maple sugar from Canada, states that “the Indians have practiced it time out of mind.”(1) An anonymous author of 1685 recorded: “The Savages have practiced this Art [of evaporating sap] longer than any now living among them can remember. Father Sebastien Rasles (1658-1724), a French missionary among the Canadian Abenakis from 1689, wrote, “It is curious to know that the method of extracting the bayberry wax and making maple sugar, articles of considerable importance to us, has been learned of the aborigines.”(2)
Among the colonists one of the first references is dated 1664, when British officials mention sugar from trees in Massachusetts.(3) Apparently the article did not enter into commerce, until very much later. The following three quotations are all for about the year 1765. An anonymous author in the London Annual Register for 1765, wrote of New England: “Of this [Maple] sugar, above 600 lb. was made by one man during the last season . . . and several hundred weight of it were in July last brought for sale to Boston in New England, from various towns situated in the northern and western parts of that province.” Peter Pond recorded in his journal that about 1765, at Mackinac, he met a great many people “sum trading with the tribes that Came a Grate Distans with thare furs, Skins & Maple Suga &c. to Market.”(4) Robert Rogers wrote in A Concise Account of North America (London, 1765) about Indians tapping maple trees, extracting sap, and boiling it, and added: “A manufactory is begun in the Province of New York, near South Bay; which, I am told, answers very well; and produces considerable quantities of powder and loaf sugar” (South Bay is near the southern end of Lake Champlain).
Interest in maple sugar came to a climax with the achievement of American Independence. In fact, it was a public obsession, involving leading figures in the new republic, and deserving the appellation of “The Great Maple Sugar Boom.” Humanitarians, especially Philadelphia Quakers, bemoaned the hard lot of West Indies slaves, who handled the sugar cane. Patriots hoped to make America self sufficient and had no desire to aid the commerce of the British Empire, which controlled the cane product and its transport. Great landholders, with vast acreages thinly occupied or entirely vacant, but covered with the sugar tree saw an opportunity to attract settlers. Not sugar alone was in the picture, but maple molasses, beer, wine, spirits and vinegar were likewise advocated.
At this point it may be well to identify some of the characters prominent in the movement so that the later narrative may not be too much interrupted. Judge William Cooper (1754-1809) of Cooperstown, New York, was a central figure, being everywhere recognized as a practical authority on the subject. He had close relations with most of the other active participants. Tench Coxe (1755-1824), of Philadelphia, was the leading economist of his day, and was Assistant Secretary of the Treasury under Alexander Hamilton. He was a grandson of Daniel Coxe, who held title to 100,000 acres in upstate New York and inherited a substantial interest in these. At times, Cooper acted as his land agent. Coxe was greatly interested in American agriculture and manufactures and most instrumental in developing the use of both coal and cotton.
John Lincklaen (1768-1822) was born in Holland, educated in Switzerland and came as a young man to America as an agent for the Holland Land Company. He visited on horseback the various locations where the Company contemplated purchases. The printed journals of his Travels in the Years 1791 and 1792 are a rich source for the topic under consideration. He was given charge of the company properties in western Chenango and Madison Counties, with headquarters at Cazenovia. Later he acquired these holdings for himself. Maple syrup is today an important product of the town of Lincklaen , Chenango County. Gerritt Boon, a Dutch sugar refiner by trade, accompanied Lincklaen to America and on his travels. He became Company agent in the Boonville area.
Arthur Noble was an Irish gentleman of means who in 1787 acquired two large tracts of land in Herkimer and Hamilton Counties. He turned to Judge Cooper for colonizing advice and for some years these two were in frequent communication. Noble’s possessions were so remote and otherwise undesirable that his plan did not prosper. Even today the population there is scant, but his part in this story cannot be neglected.
Henry Drinker (1734-1809), a prominent Quaker Philadelphia merchant, was another who used Judge Cooper’s services in land matter. They were friends before Cooper ever saw the Otsego country.
Benjamin Rush (1745-1818), the foremost American physician of his times, and after the death of Benjamin Franklin the leading citizen of Philadelphia, was a Signer of the Declaration of Independence, the son-in-law of another Signer, and the life long friend of both John Adams and Thomas Jefferson. He displayed the wide range of interests which characterized many of the great men of the period, and vigorously followed all of them.
Nothing need be said of Thomas Jefferson other than that he was an ardent advocate of large scale maple sugar manufacture and that he attempted a plantation for the purpose on his Virginia estate. Judge Cooper was no sympathizer with Jefferson’s political principles but in the matter of maple sugar they were on the same side.
Alexander Hamilton was Cooper’s personal friend, closely associated with him politically, and his attorney in several important cases at law.
Throughout all the Upper Susquehanna territory maple sugar was freely made from the beginning of settlement. There are many allusions to its manufacture during the Revolution. In April, 1780, for instance, a detail of fourteen men was sent from the Schoharie forts to spy upon the activities of suspected Loyalist near Harpersfield. While watching they were ordered to make sugar for the garrisons. These men were surprised at their task by Tories and Indians, some slain, and the rest taken captive to Canada.(5)
Willard Huntington records in his Otsego chronology (6) that in the same season Nathan Davison made a thousand pounds of sugar on the Hartwick Patent. Davison was a Massachusetts blacksmith who had been with the American army at Albany. Possibly he also was on a military assignment. Evidently he liked the spot as he became later a permanent settler there.
Directly after the peace of 1783, the sugar boom began in earnest. The next year, Jeremy Belknap, Boston clergyman, great traveler and friend of Dr. Rush, wrote while on a New Hampshire tour: “Great quantities of maple sugar are made here… They commonly make enough for a year’s store.”(7) William Cooper, in his Guide in the Wilderness comments on the extreme poverty existing about 1787 in his first settlement (Cooperstown) near Otsego Lake, and continues (page 10):
I procured from my friend Henry Drinker a credit for a large quantity of sugar kettles; he also lent me some potash kettles, which we conveyed as we best could, sometimes by partial roads on sleighs, and sometimes over the ice. By this means I established potash works among the settlers… I also gave them credit for their maple sugar and pot ash, at a price what would bear transportation, and the first year after the adoption of this plan I collected in one mass forty-three hogsheads of sugar …
In September, 1789, some seventy-two subscribers, mostly Philadelphians, “being desirous to promote & encourage the manufacture & consumption of Maple Sugar in the United States” agreed to purchase annually for three years the number of pounds of Maple Sugar set against their names, and to pay cash therefore at the rate of seven pence per pound for the first quality, and in proportion for that of inferior quality. Agents were appointed to receive the Sugar, to inspect the quality, determine the price and distribute the Sugar among the Subscribers. The list is headed by Judge Cooper’s friend, Henry Drinker, who promised to take one thousand pounds annually, and the subscribers include Henry Drinker, Jr., Nicholas Waln, Benjamin Rush, Samuel Miles (also for one thousand pounds), Clement Biddle, and William Coxe, Jr. (8)
Philadelphia’s interest in maple sugar is also attested by the publication there in 1790 of a pamphlet containing Remarks on the Manufacturing of Maple Sugar, collected by a society of gentlemen, in Philadelphia.(9) Included are the details of necessary utensils: kettles, iron ladles, screw augurs, buckets, coolers, troughs, store troughs, sugar moulds, etc., the method of tapping or boring the trees and of boiling the sap.
That the settlers in the wilderness were really helped by Judge Cooper’s procuring sugar kettles and the Philadelphia outlet for maple sugar is evident from this extract from a letter of William Cooper published in the Annual Register for 1791:
Those who think it more profit to clear them [the maples] off the ground to make way for wheat or pasture will please attend to the following receipt, taken from a farmer who had saved four acres, exposed to the northwest, and then recollect what employment is more profitable.
“Received, Cooperstown, April 30, 1790, of William Cooper, sixteen pounds, for six hundred and forty pounds of sugar, at six pence per pound; made every pound with my own hands, without any assistance, in less than four weeks; besides attending to the other business of my farm as providing firewood, taking care of cattle, etc.
Witness, Richard R. Smith, John Nicholls”
Smith was Cooper’s clerk and storekeeper and the first Otsego County sheriff. The next year Nicholls leased through Cooper Lot 28 in the Hartwick Patent, but he was probably elsewhere in 1790.
The nature of Nicholls’ affidavit indicated that it was purposefully worded for propaganda use.
The same issue of the Annual Register quotes A Society of Gentlemen as stating in 1790:
The States of New York and Pennsylvania have a sufficient number of this kind of tree to supply the whole of the United States with this article. It has moreover other things in its favor to recommend it in preference to the sugar which is imported from the West Islands. is made by the hands of freemen and at a season of the year when not a single insect exists to mix with and pollute it: whereas the West India sugar is the product of the unwilling labor of negro slaves, made in a climate and a season when insects of all kinds abound, all of which feed upon and mix with the sugar.
By 1791 the fever was reaching its height. Arthur Noble and Judge William Cooper decided to make President Washington a present of the finest maple sugar and spirits to be had. The sugar was undoubtedly made at Cooper’s sugarhouse lot north of the Index Hartwick road. The gift was taken by Noble to their friend, Dr. Rush, in Philadelphia, who promised to deliver it to Washington on his return from the southward, with a properly worded note (which note is now in the Library of Congress). Returning, Noble wrote Cooper from Canajoharie on May 7, 1791, about what he had done, and continued:
I have been bragging what a Quantity you would bring to Market this year. I hope you will not be disappointed by your Yankees, the Chancellor [James Kent] has quite failed in his Experiments he says he will lose 100 Pounds by it. His People told him it was a very bad year and the trees would not run. Rush brought me to Mr. Jefferson the Secretary of State, he is as Sanguine as you or I about the Maple Sugar, he thinks in a few years we shall be able to Supply half the World. He read me a Paragraph out of a letter from France, to tell him there is a house in Amsterdam going to Send to this Country to set up works for the Manufacturing of Maple Sugar.(10)
The “house in Amsterdam” reference foretells the appearance of the Holland Land Company in America.
On July 10, 1791, Dr. Rush addressed a very long letter to Thomas Jefferson about maple sugar. The content was read before the American Philosophical Society in August, and printed in pamphlet form as “An account of the Sugar Maple Tree, of the United States, and of the Methods of Obtaining Sugar from It, Together with Observations upon the Advantages both Public and Private of the Sugar (Philadelphia, 1792).(11) The subject was covered thoroughly, enumerating the uses of the tree, the various commodities possible to be made from the sap, the value of the sugar in medicine and as an article of diet; proposed a bounty on its manufacture; and estimated in detail the number of American families, their average annual consumption, the number of acres of maples, the yield per acre; and concluded that the nation can save $8,000,000 in imports and have a surplus worth $1,000,000 left for export.
In August and September of 1791, John Lincklaen and Gerritt Boon made their first journey. Starting from Philadelphia, they traveled through eastern and northern Pennsylvania, southern and western New York and on east to Cooperstown, where they presented to Cooper a letter of introduction from Alexander Hamilton. All the way maple trees were scrutinized and information regarding the product solicited. They returned by way of Albany and Vermont, down the Connecticut River to New York to New Haven, thence to New York City, a total of 1304 miles. They found the maple abundant in Vermont, but the industry not yet developed.
It would seem that during the visit Boon bought of Cooper with Holland Land Company money two tracts of land, one of 2,000 acres in Northern Oneida County, the other of about 265 acres on present State Route 205 one mile north of Hartwick village. (The deeds are not recorded until a later date as under the. State laws at the time aliens could not hold title to real estate without special legislative action; pending this gentlemen could have an understanding.) It also appears that Lincklaen and Boon made their home on the Hartwick patent for some time. In April, 1792, the two men set out from Otego Creek on another journey, this time through the forests of Oneida County to visit with a surveyor the first purchase mentioned. They found the lands of the best quality with “some maple.” It was a short trip, the final entry on May 3rd, 1722, stating that they left Roseboom’s Ferry (near Palatine Bridge), passed through Springfield and Coopertown, and “arrived at home in the evening having made this day 50 miles.”(12)
In his old age, Stanislas Franchot first of his name at Morrison, N.Y., wrote his recollections (published in the Cooperstown Freeman’s Journal of May 12, 1854), in which he recalled that “Messrs. Lincklaen and Boon at that time agents of the Holland Land Company made previous to their settlement of Cazenovia and Boonville, experiments in Otsego on a considerable scale in making maple sugar and satisfied themselves what could be done in that line of business.” Having completed the experiments in the Otsego area, near Cooper, the master sugar maker, and becoming located on the Black River, Boon sold his Otsego County land parcel in 1797.
In May, 1792, William Cooper was made a corresponding secretary of the New York Society for the Promotion of Agriculture, Arts and Manufactures.(13) In the Society’s Transactions for that year one of his contributions appears, with maple sugar as its topic. He asks: “If one man can procure from a tract of country less than ten miles square 50,000 pounds, what can be collected from 15,000, 000 acres?” and answers himself: “11,000,000 pounds, more sugar than was ever imported in one year” He goes on to prove the existence of those acres, and that profits from maple sugar would be $17.50 per acre annually, far greater than from cultivation. He refers to the destruction of the trees and pleads for their preservation (and mentions the harsh treatment of West Indies slaves).
On April 9, 1793, William Cooper and five others wrote from Cooperstown to Henry Drinker, Benjamin Rush and Tench Coxe of Philadelphia, informing them that “upon a moderate calculation” there had been made that season, in the former township of Otsego, at least 160,000 pounds weight of maple sugar, and continuing: “This plain demonstration of the importance of the article will, we hope, induce you to continue your endeavors to promote and encourage it”.(14)
Early in 1793, Jacob Morris, then a member of the Assembly from Otsego County, introduced a bill in the New York State Legislature for the protection of sugar trees and for a bounty on the product. That the bill ever became law has not been established, but that some persons believed that it had is evident from an unsigned copy of a power of attorney preserved among the unpublished papers of John Christopher Hartwick (owned by Hartwick College, Oneonta, N.Y.):
To all whom it concerns: This is to let you know that the subscriber has given lawful power and authority for me to eject out of the tract of land known as Hartwick all unlawful intruders and unlawful occupiers and to make them pay for the damages done in destroying the timber and especially the useful and valuable Maple Sugar Trees, which by a law of Assembly are under peculiar protection of the Government. . . I also give him authority on behalf of the owner to hire for the season persons to make sugar on the unlocated lands of the proprietor, or to grant liberty for the present season to make sugar in their own kettles, yielding and paying for it the half of the sugar so manufactured.
That the movement to popularize the maple product was widely successful is shown also in an action of the Castorland Company, a French syndicate which owned much land near Watertown. In the year 1793, this company had a silver medal struck to be presented to its directors as compensation for attending board meetings. The reverse depicts Ceres, tappings tools in hand, standing by a maple tree from which sap is flowing in a plentiful stream.(15)
In 1794, Tench Coxe published at Philadelphia A View of the United States of America which contains a chapter on maple sugar and in which he wrote (page 455): “If he [the settler] have sugar maple trees on his land, he may also obtain money, by making sugar in February and March, and selling or bartering it for cash, or goods, to be laid out in like manner in hiring hands the next season. If money be scarce in a new settlement and he barter pot ash or maple sugar for strong trousers, shirts, hats, or jackets, he will find it easy to procure laborers for such necessaries.”
After the early 1790’s, the maple sugar excitement subsided in the Otsego County area, and in general. The county did not long remain thinly inhabited. Between 1790 and 1800 its population increased more than eleven fold. To support their families the farmers had to clear the land and destroy trees. The yield of sugar fluctuated greatly from year to year, so there was not a dependable supply for market. William Cooper sold his sugar house lot in 1801. Jefferson bought Louisiana for the United States in 1803, and there cane sugar could be produced on American soil. Nevertheless the sap of the maple has remained an important element in the economy of the northeastern United States ever since the excitement of the 1790’s.
Some reference to these later days will conclude this presentation. In the summer of 1820 there appeared in the New York Statesman a series of letters on the natural history and internal resources of the State of New York.(16) Ostensibly these were written by an observant Irishman while traveling along the proposed route of the Erie Canal, then partially constructed. Actually they were contributed by DeWitt Clinton, the leading proponent of the canal, to overcome the arguments of objectors to the expensive undertaking. A quotation will show that the boom time psychology still persisted:
A plantation of maple trees of ten acres, besides being highly ornamental and beneficial for pasture besides the use of the decayed trees for fuel, and the acquisition of excellent syrup, vinegar, and molasses, and a sufficiency of sugar for family purposes, will yield a profit of $200 annually to the proprietor; and these operations are carried on in the month of March, continue but a short time, and interfere with no other business.
The forests of the north and west will supply the other parts of the state with the best of sugar and molasses through the great canals.
Susan Fenimore Cooper of Cooperstown, granddaughter of Judge William Cooper, and daughter of the novelist, James Fenimore Cooper, wrote a delightful and informative volume, Rural Hours, published anonymously, “By a Lady.” in 1850. Under date of April first, 1848, she devotes almost eight pages to the maple sugar season, from which this excerpt is quoted:
Fresh maple sugar offered for sale today, it is seldom brought to market as early as this. A large amount of this sugar is still made in our neighborhood, chiefly for home consumption on the farms. In the villages, where foreign groceries are easily procured, it is eaten more as a dainty than in any other way; the children are very fond of it. With our farmers, however, it is a matter of regular household consumption, many families depending on it altogether, keeping only a little white sugar for sickness, and it is said that children have often grown up in this county without tasting any but maple sugar.
In confirmation, the Federal census for 1850 shows 384,996 pounds of sugar and 2,990 gallons of syrup made in Otsego County the preceding year.
Under the tariff law of 1891, a bounty of two cents a pound was offered to American sugar producers for a period of four years, New York and Vermont farmers, as well as Louisiana cane growers, took advantage of this generosity. So after a century one of the dreams of the early promoters came true.
The materials here presented have come form a wide variety of sources, but the writer is particularly indebted to Dr. Lyman H. Butterfield, the present day authority of Dr. Benjamin Rush and his circle, and to Dr. H. A. Schuette, who is mainly responsible for the extensive bibliography on Maple Sugar, printed in the transactions of the Wisconsin Academy of Sciences. Arts and Letters, volume 29 (1935), pp.209-236, and volume 38 (1946), pp. 89-184. Dr Schuette reprinted 219 references to maple sugar from contemporary accounts dating from the sixteenth century.
1. Philadelphia Magazine (1798), 1: 322, printed in Schuette and Schuette, “Maple Sugar: A Bibliography of Early Records” in Transactions, Wisconsin Academy of Sciences Arts and Letters vol. 29,p.211 (no.6). Hereafter cited as Schuette, with the volume number and entry number in the Transactions.
2. Sebastien Rasles, Lettres edifiantes et curieuses (Paris, 1726), p. 252, quoted in Helen and Scott Nearing, The Maple Sugar Book (The John Day Company, New York, 1950), p. 24.
3. Robert Boyle’s Some Considerations (Oxford, 1664, 2nd ed., p. 102) quoted in Schuette, vol. 38, no. 83.
4. The Connecticut Magazine, 10 (1906), 244, quoted in Schuette, vol. 38 no. 101.
5. Jeptha R. Simms, History of Schoharie County (Albany, 1845). pp. 325- 26, and passim for other references to maple sugar.
6. Willard V. Huntington’s manuscript “Old Time Notes,” in the Huntington Library, Oneonta, N.Y., typewritten copy, p. 564.
7. Collections of the Massachusetts Historical Society (1877), 3, 181, quoted in Schuette, 29, no. 23.
8. In the William Cooper manuscripts owned by Mr. Paul Fenimore Cooper of Cooperstown, quoted with his permission. There is a photostatic copy of the subscription paper in the library of the New York State Historical Association, Fenimore House, Cooperstown.
9. Reprinted in A. F. M. Willich’s The Domestic Encyclopedia (2nd American edition, Philadelphia, 1821), 11: 292-96, and in The Chronicle of the Early American Industries Association for April, 1945, vol. III, no. 3, pp. 21-23, 28, 34.
10. James Fenimore Cooper (1858- 1938), The Legends and Tradition a Northern County (New York, 1921), pp. 139-40. 11. Lyman H, Butterfield, ed, Letters of Benjamin Rush (1951) 1:587-97.
11. Lyman H. Butterfield, ed., Letters of Benjamin Rush (1951) I:587-97.
12. Travels in the years 1791 and 1792 in Pennsylvania, New York and Vermont; journals of John Lincklaen, agent of the Holland Land Company (New York, 1897), edited by Helen H. Fairchild; Otsego County conveyances, in the County Clerk’s Office, Cooperstown.
13. Letter from Robert H. Livingston to William Cooper, dated New York, May 21, 1792, notifying Cooper of his election as corresponding secretary, in the William Cooper manuscripts owned by Mr. Paul Fenimore Cooper, of Cooperstown.
14. In Tench Coxe’s A View of the United States of America . . . (Philadelphia 1794, London 1795), p. 80.
15. T. Wood Clarke, Emigre’s in the Wilderness (New York, 1941), p. 32, where the Castorland Medal is illustrated.
16. They were printed in book form at New York in 1822, with the pseudonym “Hibernicus” with the title: Letters on the Natural History and Internal Resources of the State of New York. The quotation about maple trees is on page 31.
Directly after the peace of 1783, the sugar boom began in earnest. The next year, Jeremy Belknap, Boston clergyman, great traveler and friend of Dr. Rush, wrote while on a New Hampshire tour: “Great quantities of maple sugar are made here… They commonly make enough for a year’s store.”(7) William Cooper, in his Guide in the Wilderness comments on the extreme poverty existing about 1787 in his first settlement (Cooperstown) near Otsego Lake, and continues (page 10):
I procured from my friend Henry Drinker a credit for a large quantity of sugar kettles; he also lent me some potash kettles, which we conveyed as we best could, sometimes by partial roads on sleighs, and sometimes over the ice. By this means I established potash works among the settlers… I also gave them credit for their maple sugar and pot ash, at a price what would bear transportation, and the first year after the adoption of this plan I collected in one mass forty-three hogsheads of sugar …
In September, 1789, some seventy-two subscribers, mostly Philadelphians, “being desirous to promote & encourage the manufacture & consumption of Maple Sugar in the United States” agreed to purchase annually for three years the number of pounds of Maple Sugar set against their names, and to pay cash therefore at the rate of seven pence per pound for the first quality, and in proportion for that of inferior quality. Agents were appointed to receive the Sugar, to inspect the quality, determine the price and distribute the Sugar among the Subscribers. The list is headed by Judge Cooper’s friend, Henry Drinker, who promised to take one thousand pounds annually, and the subscribers include Henry Drinker, Jr., Nicholas Waln, Benjamin Rush, Samuel Miles (also for one thousand pounds), Clement Biddle, and William Coxe, Jr. (8)
Philadelphia’s interest in maple sugar is also attested by the publication there in 1790 of a pamphlet containing Remarks on the Manufacturing of Maple Sugar, collected by a society of gentlemen, in Philadelphia.(9) Included are the details of necessary utensils: kettles, iron ladles, screw augurs, buckets, coolers, troughs, store troughs, sugar moulds, etc., the method of tapping or boring the trees and of boiling the sap.
That the settlers in the wilderness were really helped by Judge Cooper’s procuring sugar kettles and the Philadelphia outlet for maple sugar is evident from this extract from a letter of William Cooper published in the Annual Register for 1791:
Those who think it more profit to clear them [the maples] off the ground to make way for wheat or pasture will please attend to the following receipt, taken from a farmer who had saved four acres, exposed to the northwest, and then recollect what employment is more profitable.
“Received, Cooperstown, April 30, 1790, of William Cooper, sixteen pounds, for six hundred and forty pounds of sugar, at six pence per pound; made every pound with my own hands, without any assistance, in less than four weeks; besides attending to the other business of my farm as providing firewood, taking care of cattle, etc.
Witness, Richard R. Smith, John Nicholls”
Smith was Cooper’s clerk and storekeeper and the first Otsego County sheriff. The next year Nicholls leased through Cooper Lot 28 in the Hartwick Patent, but he was probably elsewhere in 1790.
The nature of Nicholls’ affidavit indicated that it was purposefully worded for propaganda use.
The same issue of the Annual Register quotes A Society of Gentlemen as stating in 1790:
The States of New York and Pennsylvania have a sufficient number of this kind of tree to supply the whole of the United States with this article. It has moreover other things in its favor to recommend it in preference to the sugar which is imported from the West Islands. is made by the hands of freemen and at a season of the year when not a single insect exists to mix with and pollute it: whereas the West India sugar is the product of the unwilling labor of negro slaves, made in a climate and a season when insects of all kinds abound, all of which feed upon and mix with the sugar.
By 1791 the fever was reaching its height. Arthur Noble and Judge William Cooper decided to make President Washington a present of the finest maple sugar and spirits to be had. The sugar was undoubtedly made at Cooper’s sugarhouse lot north of the Index Hartwick road. The gift was taken by Noble to their friend, Dr. Rush, in Philadelphia, who promised to deliver it to Washington on his return from the southward, with a properly worded note (which note is now in the Library of Congress). Returning, Noble wrote Cooper from Canajoharie on May 7, 1791, about what he had done, and continued:
I have been bragging what a Quantity you would bring to Market this year. I hope you will not be disappointed by your Yankees, the Chancellor [James Kent] has quite failed in his Experiments he says he will lose 100 Pounds by it. His People told him it was a very bad year and the trees would not run. Rush brought me to Mr. Jefferson the Secretary of State, he is as Sanguine as you or I about the Maple Sugar, he thinks in a few years we shall be able to Supply half the World. He read me a Paragraph out of a letter from France, to tell him there is a house in Amsterdam going to Send to this Country to set up works for the Manufacturing of Maple Sugar.(10)
The “house in Amsterdam” reference foretells the appearance of the Holland Land Company in America.
On July 10, 1791, Dr. Rush addressed a very long letter to Thomas Jefferson about maple sugar. The content was read before the American Philosophical Society in August, and printed in pamphlet form as “An account of the Sugar Maple Tree, of the United States, and of the Methods of Obtaining Sugar from It, Together with Observations upon the Advantages both Public and Private of the Sugar (Philadelphia, 1792).(11) The subject was covered thoroughly, enumerating the uses of the tree, the various commodities possible to be made from the sap, the value of the sugar in medicine and as an article of diet; proposed a bounty on its manufacture; and estimated in detail the number of American families, their average annual consumption, the number of acres of maples, the yield per acre; and concluded that the nation can save $8,000,000 in imports and have a surplus worth $1,000,000 left for export.
In August and September of 1791, John Lincklaen and Gerritt Boon made their first journey. Starting from Philadelphia, they traveled through eastern and northern Pennsylvania, southern and western New York and on east to Cooperstown, where they presented to Cooper a letter of introduction from Alexander Hamilton. All the way maple trees were scrutinized and information regarding the product solicited. They returned by way of Albany and Vermont, down the Connecticut River to New York to New Haven, thence to New York City, a total of 1304 miles. They found the maple abundant in Vermont, but the industry not yet developed.
It would seem that during the visit Boon bought of Cooper with Holland Land Company money two tracts of land, one of 2,000 acres in Northern Oneida County, the other of about 265 acres on present State Route 205 one mile north of Hartwick village. (The deeds are not recorded until a later date as under the. State laws at the time aliens could not hold title to real estate without special legislative action; pending this gentlemen could have an understanding.) It also appears that Lincklaen and Boon made their home on the Hartwick patent for some time. In April, 1792, the two men set out from Otego Creek on another journey, this time through the forests of Oneida County to visit with a surveyor the first purchase mentioned. They found the lands of the best quality with “some maple.” It was a short trip, the final entry on May 3rd, 1722, stating that they left Roseboom’s Ferry (near Palatine Bridge), passed through Springfield and Coopertown, and “arrived at home in the evening having made this day 50 miles.”(12)
In his old age, Stanislas Franchot first of his name at Morrison, N.Y., wrote his recollections (published in the Cooperstown Freeman’s Journal of May 12, 1854), in which he recalled that “Messrs. Lincklaen and Boon at that time agents of the Holland Land Company made previous to their settlement of Cazenovia and Boonville, experiments in Otsego on a considerable scale in making maple sugar and satisfied themselves what could be done in that line of business.” Having completed the experiments in the Otsego area, near Cooper, the master sugar maker, and becoming located on the Black River, Boon sold his Otsego County land parcel in 1797.
In May, 1792, William Cooper was made a corresponding secretary of the New York Society for the Promotion of Agriculture, Arts and Manufactures.(13) In the Society’s Transactions for that year one of his contributions appears, with maple sugar as its topic. He asks: “If one man can procure from a tract of country less than ten miles square 50,000 pounds, what can be collected from 15,000, 000 acres?” and answers himself: “11,000,000 pounds, more sugar than was ever imported in one year” He goes on to prove the existence of those acres, and that profits from maple sugar would be $17.50 per acre annually, far greater than from cultivation. He refers to the destruction of the trees and pleads for their preservation (and mentions the harsh treatment of West Indies slaves).
On April 9, 1793, William Cooper and five others wrote from Cooperstown to Henry Drinker, Benjamin Rush and Tench Coxe of Philadelphia, informing them that “upon a moderate calculation” there had been made that season, in the former township of Otsego, at least 160,000 pounds weight of maple sugar, and continuing: “This plain demonstration of the importance of the article will, we hope, induce you to continue your endeavors to promote and encourage it”.(14)
Early in 1793, Jacob Morris, then a member of the Assembly from Otsego County, introduced a bill in the New York State Legislature for the protection of sugar trees and for a bounty on the product. That the bill ever became law has not been established, but that some persons believed that it had is evident from an unsigned copy of a power of attorney preserved among the unpublished papers of John Christopher Hartwick (owned by Hartwick College, Oneonta, N.Y.):
To all whom it concerns: This is to let you know that the subscriber has given lawful power and authority for me to eject out of the tract of land known as Hartwick all unlawful intruders and unlawful occupiers and to make them pay for the damages done in destroying the timber and especially the useful and valuable Maple Sugar Trees, which by a law of Assembly are under peculiar protection of the Government. . . I also give him authority on behalf of the owner to hire for the season persons to make sugar on the unlocated lands of the proprietor, or to grant liberty for the present season to make sugar in their own kettles, yielding and paying for it the half of the sugar so manufactured.
That the movement to popularize the maple product was widely successful is shown also in an action of the Castorland Company, a French syndicate which owned much land near Watertown. In the year 1793, this company had a silver medal struck to be presented to its directors as compensation for attending board meetings. The reverse depicts Ceres, tappings tools in hand, standing by a maple tree from which sap is flowing in a plentiful stream.(15)
In 1794, Tench Coxe published at Philadelphia A View of the United States of America which contains a chapter on maple sugar and in which he wrote (page 455): “If he [the settler] have sugar maple trees on his land, he may also obtain money, by making sugar in February and March, and selling or bartering it for cash, or goods, to be laid out in like manner in hiring hands the next season. If money be scarce in a new settlement and he barter pot ash or maple sugar for strong trousers, shirts, hats, or jackets, he will find it easy to procure laborers for such necessaries.”
After the early 1790’s, the maple sugar excitement subsided in the Otsego County area, and in general. The county did not long remain thinly inhabited. Between 1790 and 1800 its population increased more than eleven fold. To support their families the farmers had to clear the land and destroy trees. The yield of sugar fluctuated greatly from year to year, so there was not a dependable supply for market. William Cooper sold his sugar house lot in 1801. Jefferson bought Louisiana for the United States in 1803, and there cane sugar could be produced on American soil. Nevertheless the sap of the maple has remained an important element in the economy of the northeastern United States ever since the excitement of the 1790’s.
Some reference to these later days will conclude this presentation. In the summer of 1820 there appeared in the New York Statesman a series of letters on the natural history and internal resources of the State of New York.(16) Ostensibly these were written by an observant Irishman while traveling along the proposed route of the Erie Canal, then partially constructed. Actually they were contributed by DeWitt Clinton, the leading proponent of the canal, to overcome the arguments of objectors to the expensive undertaking. A quotation will show that the boom time psychology still persisted:
A plantation of maple trees of ten acres, besides being highly ornamental and beneficial for pasture besides the use of the decayed trees for fuel, and the acquisition of excellent syrup, vinegar, and molasses, and a sufficiency of sugar for family purposes, will yield a profit of $200 annually to the proprietor; and these operations are carried on in the month of March, continue but a short time, and interfere with no other business.
The forests of the north and west will supply the other parts of the state with the best of sugar and molasses through the great canals.
Susan Fenimore Cooper of Cooperstown, granddaughter of Judge William Cooper, and daughter of the novelist, James Fenimore Cooper, wrote a delightful and informative volume, Rural Hours, published anonymously, “By a Lady.” in 1850. Under date of April first, 1848, she devotes almost eight pages to the maple sugar season, from which this excerpt is quoted:
Fresh maple sugar offered for sale today, it is seldom brought to market as early as this. A large amount of this sugar is still made in our neighborhood, chiefly for home consumption on the farms. In the villages, where foreign groceries are easily procured, it is eaten more as a dainty than in any other way; the children are very fond of it. With our farmers, however, it is a matter of regular household consumption, many families depending on it altogether, keeping only a little white sugar for sickness, and it is said that children have often grown up in this county without tasting any but maple sugar.
In confirmation, the Federal census for 1850 shows 384,996 pounds of sugar and 2,990 gallons of syrup made in Otsego County the preceding year.
Under the tariff law of 1891, a bounty of two cents a pound was offered to American sugar producers for a period of four years, New York and Vermont farmers, as well as Louisiana cane growers, took advantage of this generosity. So after a century one of the dreams of the early promoters came true.
The materials here presented have come form a wide variety of sources, but the writer is particularly indebted to Dr. Lyman H. Butterfield, the present day authority of Dr. Benjamin Rush and his circle, and to Dr. H. A. Schuette, who is mainly responsible for the extensive bibliography on Maple Sugar, printed in the transactions of the Wisconsin Academy of Sciences. Arts and Letters, volume 29 (1935), pp.209-236, and volume 38 (1946), pp. 89-184. Dr Schuette reprinted 219 references to maple sugar from contemporary accounts dating from the sixteenth century.
1. Philadelphia Magazine (1798), 1: 322, printed in Schuette and Schuette, “Maple Sugar: A Bibliography of Early Records” in Transactions, Wisconsin Academy of Sciences Arts and Letters vol. 29,p.211 (no.6). Hereafter cited as Schuette, with the volume number and entry number in the Transactions.
2. Sebastien Rasles, Lettres edifiantes et curieuses (Paris, 1726), p. 252, quoted in Helen and Scott Nearing, The Maple Sugar Book (The John Day Company, New York, 1950), p. 24.
3. Robert Boyle’s Some Considerations (Oxford, 1664, 2nd ed., p. 102) quoted in Schuette, vol. 38, no. 83.
4. The Connecticut Magazine, 10 (1906), 244, quoted in Schuette, vol. 38 no. 101.
5. Jeptha R. Simms, History of Schoharie County (Albany, 1845). pp. 325- 26, and passim for other references to maple sugar.
6. Willard V. Huntington’s manuscript “Old Time Notes,” in the Huntington Library, Oneonta, N.Y., typewritten copy, p. 564.
7. Collections of the Massachusetts Historical Society (1877), 3, 181, quoted in Schuette, 29, no. 23.
8. In the William Cooper manuscripts owned by Mr. Paul Fenimore Cooper of Cooperstown, quoted with his permission. There is a photostatic copy of the subscription paper in the library of the New York State Historical Association, Fenimore House, Cooperstown.
9. Reprinted in A. F. M. Willich’s The Domestic Encyclopedia (2nd American edition, Philadelphia, 1821), 11: 292-96, and in The Chronicle of the Early American Industries Association for April, 1945, vol. III, no. 3, pp. 21-23, 28, 34.
10. James Fenimore Cooper (1858- 1938), The Legends and Tradition a Northern County (New York, 1921), pp. 139-40. 11. Lyman H, Butterfield, ed, Letters of Benjamin Rush (1951) 1:587-97.
11. Lyman H. Butterfield, ed., Letters of Benjamin Rush (1951) I:587-97.
12. Travels in the years 1791 and 1792 in Pennsylvania, New York and Vermont; journals of John Lincklaen, agent of the Holland Land Company (New York, 1897), edited by Helen H. Fairchild; Otsego County conveyances, in the County Clerk’s Office, Cooperstown.
13. Letter from Robert H. Livingston to William Cooper, dated New York, May 21, 1792, notifying Cooper of his election as corresponding secretary, in the William Cooper manuscripts owned by Mr. Paul Fenimore Cooper, of Cooperstown.
14. In Tench Coxe’s A View of the United States of America . . . (Philadelphia 1794, London 1795), p. 80.
15. T. Wood Clarke, Emigre’s in the Wilderness (New York, 1941), p. 32, where the Castorland Medal is illustrated.
16. They were printed in book form at New York in 1822, with the pseudonym “Hibernicus” with the title: Letters on the Natural History and Internal Resources of the State of New York. The quotation about maple trees is on page 31.
The “house in Amsterdam” reference foretells the appearance of the Holland Land Company in America.
On July 10, 1791, Dr. Rush addressed a very long letter to Thomas Jefferson about maple sugar. The content was read before the American Philosophical Society in August, and printed in pamphlet form as “An account of the Sugar Maple Tree, of the United States, and of the Methods of Obtaining Sugar from It, Together with Observations upon the Advantages both Public and Private of the Sugar (Philadelphia, 1792).(11) The subject was covered thoroughly, enumerating the uses of the tree, the various commodities possible to be made from the sap, the value of the sugar in medicine and as an article of diet; proposed a bounty on its manufacture; and estimated in detail the number of American families, their average annual consumption, the number of acres of maples, the yield per acre; and concluded that the nation can save $8,000,000 in imports and have a surplus worth $1,000,000 left for export.
In August and September of 1791, John Lincklaen and Gerritt Boon made their first journey. Starting from Philadelphia, they traveled through eastern and northern Pennsylvania, southern and western New York and on east to Cooperstown, where they presented to Cooper a letter of introduction from Alexander Hamilton. All the way maple trees were scrutinized and information regarding the product solicited. They returned by way of Albany and Vermont, down the Connecticut River to New York to New Haven, thence to New York City, a total of 1304 miles. They found the maple abundant in Vermont, but the industry not yet developed.
It would seem that during the visit Boon bought of Cooper with Holland Land Company money two tracts of land, one of 2,000 acres in Northern Oneida County, the other of about 265 acres on present State Route 205 one mile north of Hartwick village. (The deeds are not recorded until a later date as under the. State laws at the time aliens could not hold title to real estate without special legislative action; pending this gentlemen could have an understanding.) It also appears that Lincklaen and Boon made their home on the Hartwick patent for some time. In April, 1792, the two men set out from Otego Creek on another journey, this time through the forests of Oneida County to visit with a surveyor the first purchase mentioned. They found the lands of the best quality with “some maple.” It was a short trip, the final entry on May 3rd, 1722, stating that they left Roseboom’s Ferry (near Palatine Bridge), passed through Springfield and Coopertown, and “arrived at home in the evening having made this day 50 miles.”(12)
In his old age, Stanislas Franchot first of his name at Morrison, N.Y., wrote his recollections (published in the Cooperstown Freeman’s Journal of May 12, 1854), in which he recalled that “Messrs. Lincklaen and Boon at that time agents of the Holland Land Company made previous to their settlement of Cazenovia and Boonville, experiments in Otsego on a considerable scale in making maple sugar and satisfied themselves what could be done in that line of business.” Having completed the experiments in the Otsego area, near Cooper, the master sugar maker, and becoming located on the Black River, Boon sold his Otsego County land parcel in 1797.
In May, 1792, William Cooper was made a corresponding secretary of the New York Society for the Promotion of Agriculture, Arts and Manufactures.(13) In the Society’s Transactions for that year one of his contributions appears, with maple sugar as its topic. He asks: “If one man can procure from a tract of country less than ten miles square 50,000 pounds, what can be collected from 15,000, 000 acres?” and answers himself: “11,000,000 pounds, more sugar than was ever imported in one year” He goes on to prove the existence of those acres, and that profits from maple sugar would be $17.50 per acre annually, far greater than from cultivation. He refers to the destruction of the trees and pleads for their preservation (and mentions the harsh treatment of West Indies slaves).
On April 9, 1793, William Cooper and five others wrote from Cooperstown to Henry Drinker, Benjamin Rush and Tench Coxe of Philadelphia, informing them that “upon a moderate calculation” there had been made that season, in the former township of Otsego, at least 160,000 pounds weight of maple sugar, and continuing: “This plain demonstration of the importance of the article will, we hope, induce you to continue your endeavors to promote and encourage it”.(14)
Early in 1793, Jacob Morris, then a member of the Assembly from Otsego County, introduced a bill in the New York State Legislature for the protection of sugar trees and for a bounty on the product. That the bill ever became law has not been established, but that some persons believed that it had is evident from an unsigned copy of a power of attorney preserved among the unpublished papers of John Christopher Hartwick (owned by Hartwick College, Oneonta, N.Y.):
To all whom it concerns: This is to let you know that the subscriber has given lawful power and authority for me to eject out of the tract of land known as Hartwick all unlawful intruders and unlawful occupiers and to make them pay for the damages done in destroying the timber and especially the useful and valuable Maple Sugar Trees, which by a law of Assembly are under peculiar protection of the Government. . . I also give him authority on behalf of the owner to hire for the season persons to make sugar on the unlocated lands of the proprietor, or to grant liberty for the present season to make sugar in their own kettles, yielding and paying for it the half of the sugar so manufactured.
That the movement to popularize the maple product was widely successful is shown also in an action of the Castorland Company, a French syndicate which owned much land near Watertown. In the year 1793, this company had a silver medal struck to be presented to its directors as compensation for attending board meetings. The reverse depicts Ceres, tappings tools in hand, standing by a maple tree from which sap is flowing in a plentiful stream.(15)
In 1794, Tench Coxe published at Philadelphia A View of the United States of America which contains a chapter on maple sugar and in which he wrote (page 455): “If he [the settler] have sugar maple trees on his land, he may also obtain money, by making sugar in February and March, and selling or bartering it for cash, or goods, to be laid out in like manner in hiring hands the next season. If money be scarce in a new settlement and he barter pot ash or maple sugar for strong trousers, shirts, hats, or jackets, he will find it easy to procure laborers for such necessaries.”
After the early 1790’s, the maple sugar excitement subsided in the Otsego County area, and in general. The county did not long remain thinly inhabited. Between 1790 and 1800 its population increased more than eleven fold. To support their families the farmers had to clear the land and destroy trees. The yield of sugar fluctuated greatly from year to year, so there was not a dependable supply for market. William Cooper sold his sugar house lot in 1801. Jefferson bought Louisiana for the United States in 1803, and there cane sugar could be produced on American soil. Nevertheless the sap of the maple has remained an important element in the economy of the northeastern United States ever since the excitement of the 1790’s.
Some reference to these later days will conclude this presentation. In the summer of 1820 there appeared in the New York Statesman a series of letters on the natural history and internal resources of the State of New York.(16) Ostensibly these were written by an observant Irishman while traveling along the proposed route of the Erie Canal, then partially constructed. Actually they were contributed by DeWitt Clinton, the leading proponent of the canal, to overcome the arguments of objectors to the expensive undertaking. A quotation will show that the boom time psychology still persisted:
A plantation of maple trees of ten acres, besides being highly ornamental and beneficial for pasture besides the use of the decayed trees for fuel, and the acquisition of excellent syrup, vinegar, and molasses, and a sufficiency of sugar for family purposes, will yield a profit of $200 annually to the proprietor; and these operations are carried on in the month of March, continue but a short time, and interfere with no other business.
The forests of the north and west will supply the other parts of the state with the best of sugar and molasses through the great canals.
Susan Fenimore Cooper of Cooperstown, granddaughter of Judge William Cooper, and daughter of the novelist, James Fenimore Cooper, wrote a delightful and informative volume, Rural Hours, published anonymously, “By a Lady.” in 1850. Under date of April first, 1848, she devotes almost eight pages to the maple sugar season, from which this excerpt is quoted:
Fresh maple sugar offered for sale today, it is seldom brought to market as early as this. A large amount of this sugar is still made in our neighborhood, chiefly for home consumption on the farms. In the villages, where foreign groceries are easily procured, it is eaten more as a dainty than in any other way; the children are very fond of it. With our farmers, however, it is a matter of regular household consumption, many families depending on it altogether, keeping only a little white sugar for sickness, and it is said that children have often grown up in this county without tasting any but maple sugar.
In confirmation, the Federal census for 1850 shows 384,996 pounds of sugar and 2,990 gallons of syrup made in Otsego County the preceding year.
Under the tariff law of 1891, a bounty of two cents a pound was offered to American sugar producers for a period of four years, New York and Vermont farmers, as well as Louisiana cane growers, took advantage of this generosity. So after a century one of the dreams of the early promoters came true.
The materials here presented have come form a wide variety of sources, but the writer is particularly indebted to Dr. Lyman H. Butterfield, the present day authority of Dr. Benjamin Rush and his circle, and to Dr. H. A. Schuette, who is mainly responsible for the extensive bibliography on Maple Sugar, printed in the transactions of the Wisconsin Academy of Sciences. Arts and Letters, volume 29 (1935), pp.209-236, and volume 38 (1946), pp. 89-184. Dr Schuette reprinted 219 references to maple sugar from contemporary accounts dating from the sixteenth century.
1. Philadelphia Magazine (1798), 1: 322, printed in Schuette and Schuette, “Maple Sugar: A Bibliography of Early Records” in Transactions, Wisconsin Academy of Sciences Arts and Letters vol. 29,p.211 (no.6). Hereafter cited as Schuette, with the volume number and entry number in the Transactions.
2. Sebastien Rasles, Lettres edifiantes et curieuses (Paris, 1726), p. 252, quoted in Helen and Scott Nearing, The Maple Sugar Book (The John Day Company, New York, 1950), p. 24.
3. Robert Boyle’s Some Considerations (Oxford, 1664, 2nd ed., p. 102) quoted in Schuette, vol. 38, no. 83.
4. The Connecticut Magazine, 10 (1906), 244, quoted in Schuette, vol. 38 no. 101.
5. Jeptha R. Simms, History of Schoharie County (Albany, 1845). pp. 325- 26, and passim for other references to maple sugar.
6. Willard V. Huntington’s manuscript “Old Time Notes,” in the Huntington Library, Oneonta, N.Y., typewritten copy, p. 564.
7. Collections of the Massachusetts Historical Society (1877), 3, 181, quoted in Schuette, 29, no. 23.
8. In the William Cooper manuscripts owned by Mr. Paul Fenimore Cooper of Cooperstown, quoted with his permission. There is a photostatic copy of the subscription paper in the library of the New York State Historical Association, Fenimore House, Cooperstown.
9. Reprinted in A. F. M. Willich’s The Domestic Encyclopedia (2nd American edition, Philadelphia, 1821), 11: 292-96, and in The Chronicle of the Early American Industries Association for April, 1945, vol. III, no. 3, pp. 21-23, 28, 34.
10. James Fenimore Cooper (1858- 1938), The Legends and Tradition a Northern County (New York, 1921), pp. 139-40. 11. Lyman H, Butterfield, ed, Letters of Benjamin Rush (1951) 1:587-97.
11. Lyman H. Butterfield, ed., Letters of Benjamin Rush (1951) I:587-97.
12. Travels in the years 1791 and 1792 in Pennsylvania, New York and Vermont; journals of John Lincklaen, agent of the Holland Land Company (New York, 1897), edited by Helen H. Fairchild; Otsego County conveyances, in the County Clerk’s Office, Cooperstown.
13. Letter from Robert H. Livingston to William Cooper, dated New York, May 21, 1792, notifying Cooper of his election as corresponding secretary, in the William Cooper manuscripts owned by Mr. Paul Fenimore Cooper, of Cooperstown.
14. In Tench Coxe’s A View of the United States of America . . . (Philadelphia 1794, London 1795), p. 80.
15. T. Wood Clarke, Emigre’s in the Wilderness (New York, 1941), p. 32, where the Castorland Medal is illustrated.
16. They were printed in book form at New York in 1822, with the pseudonym “Hibernicus” with the title: Letters on the Natural History and Internal Resources of the State of New York. The quotation about maple trees is on page 31.
The Quebec Maple Story
Extension
Maple Syrup Digest
A.R.C. Jones, MacDonald College, Quebec
Vol. 7, No. 3
October 1968
REF# 122
When it comes to maple syrup and sugar production, Quebec considers herself, and rightly so, to be the queen of the maple bush. In terms of gallonage, Quebec producers together with a smaller number in Ontario and the Maritime Provinces, have topped the combined output of all eleven maple producing states in the United States since somewhere between 1935 and 1940 when total Canadian production expressed in U.S. gallons reached over 3,500,00 gallons. Canadian production in 1966 was 3,226,000 imperial gallons, with a gross value of $14,558,000. United States imports of Canadian syrup and sugar have equaled, or surpassed, the total U.S. output of syrup and sugar since 1958 when it amounted to 1,408,000 gallons – I might hopefully add, long may it continue. These importations were close to 50 per cent of the Canadian production at that time (1958) and are now closer to 70 per cent. Canada, and Quebec in particular, would be in a bad way without this strong U.S. demand for her maple products (Taylor, Pasto and Southworth, 1967). The Quebec contribution to the most recent (1966) Canadian production amounts to 91 per cent – 70 per cent of world supply, or 2,904, 000 gallons valued at $12,322,000.
The 1961 census gives some useful data on production and the location of the largest number of producers. In 1961 there were 17,282 maple groves operated in Quebec against 21,700 in 1951, a decline of 18 per cent. The number of tapholes for the two years under review was 21,499,191 and 22,443,061 respectively, representing an average of 1,244 taps per farm in 1961 and 1,034 in 1951 (Quebec Bureau of Statistics Maple Products 1964). It is estimated that there is an untapped potential in the Province of 100 million tapholes on top of the current 21,500,000.
Approximately 22 percent of Quebec commercial forest land is composed of broad leaf species, including maple. The greatest concentration of producers is to be found in the counties of Beauce, Megantic and Dorchester south of Quebec City, where there are more than 1000 producers per county. Beauce leads all other counties in the Province, with close to 2000 producers. Ontario, the second largest maple province, had 4,759 producers in 1961, with only two counties, Gray and Hastings, containing more than 300 active producers. In Quebec, there are eighteen counties reporting more than 300 producers; all of these, except three, are on the south shore of the St. Lawrence.
From the earliest times, Quebecoise have looked on sugaring in March and April as a gala time to celebrate the coming of spring. Even now, many families traditionally come together at this time from far away points to help with the harvest and to celebrate the end of the long winter. In the early days there was another reason for not missing the sugaring season, maple syrup was the only source of sugar.
Since those times, the Province has continued to maintain its lead in the maple industry, gradually modernizing grading standards and production methods. In 1967, the Department of Agriculture and Colonization under its new chief of honey and maple products, Mr. Jean Guilbault, together with Mr Roch Delisle, Director, Service de la Forêt Rurale of Lands and Forests, embarked on a vigorous research and field trial programme in a rented sugarbush in Arthabaska to study such recent developments in the industry as taphole sanitizing pellets, various plastic tubing systems, vacuum sap pumping, covered and oil fired evaporators and sugarbush management. This work is to be expanded in 1969.
Figure 1. Left to right: Norval Blair & son, speaking to N.Y. Maple Tour; A.R.C. Jones, author; William Andrews, Franklin County Ext. Agent; and Fred Winch N.Y. Extension Forester.
Mr. Delisle (1967) recommends the division of the Province into three tapping zones based on relative tree vigour. These zones are as follows: Zone I (southern) suggests one tap for trees 8-15 inches d.b.h., two taps for trees 16-20 inches and three taps for trees 21 inches and larger. Zone 11 adds one inch to the maximum size of Zone 1, and in Zone III (northern) it is recommended there be one tap for trees 8-17 inches d.b.h. and two taps for trees 18 inches and larger.
In the late fall of 1967 and the spring of 1968 a questionnaire was circulated by the Department of Agriculture and Colonization to all sugar producers in the Province to attempt to obtain up-to-date information on the situation. There has been an excellent response to this questionnaire, and when the results of this enquiry have been compiled, there will be some excellent information on the current state of the industry in the Province. For many years, the Department of Agriculture and Colonization has maintained a syrup testing laboratory in Quebec and chemists and technicians from this laboratory have trained inspectors who work closely with the large bulk syrup buyers in order to maintain the grading standards for domestic and export sale of maple products. Grading is now done with an electronic colorometer. Unlike the other Canadian Provinces, only 30 per cent of the annual Quebec maple crop is sold directly to the consumer. The remaining 70 per cent is purchased in bulk form on a per pound basis in 30 gallon drums by five large maple syrup processors and wholesalers. These firms, in most cases, produce their own brands of pure syrup, such as Citadelle, Camp, Grove, Old Colony, and others, from the higher grades purchased (Grades AA, A and B). The lower grades, B, C and D, are largely exported to the United States for remanufacture into blended syrups. You may not be aware of the fact that federal law prohibits the sale of all but pure maple products in Canada. However, artificial table syrups are permitted and each spring well over a million pounds of artificial syrup is produced to augment the natural harvest. La Societe les Producteurs de Sucre d’Erable de Quebec is estimated to control approximately 50 to 60 per cent of the bulk market, purchasing from about 6000 producers who are registered members of their cooparative. This firm has been in operation since 1924 and, under normal conditions, they set the price to be paid for Canadian bulk syrup. In recent years, it has been around 30 to 33 cents per pound for Fancy to 22 to 26 cents per pound for Grade D. Usually there is a bonus of one or two cents per pound paid just prior to the beginning of the next sugaring season in 1967 this was two-thirds cent per lb. The price of container syrup is generally determined by production costs and the state of the market around $6.00 to $6.50 per gallon was the current price paid for Quebec Fancy syrup in 1968.
Quebec, as I have said, has a long tradition connected with the maple industry, and a considerable folk lore has built up around sugaring, sugar parties and Festivals d’Erable. Huntingdon is no exception to these traditions, although they may have started later than in the areas around Quebec city. Earliest settlement of Huntingdon occurred in 1790, but it was not until 1820 that settlers arrived in large numbers. The early settlers were heavily dependent on the forest for their livelihood, and by 1930 the extensive maple forests in the region had been heavily depleted for potash production and by lumbering. After this time, the expanding population directed its attention to agriculture. In 1853, a pulp and paper mill was established at Valleyfield in Beauharnois county to the north, and in 1869 the first ground wood pulp in North America was manufactured at this plant. During the 46 years the mill operated, a substantial part of its raw material was acquired from the virgin and second growth forests of Huntingdon county. In the first 25 years of the present century, several firms swept through the best remaining stands of timber near Covey Hill and along the American border. In the past 35 years, the remaining woodlands have been reduced to their present condition by several stages of depletion: (1) the depression of the 30’s which saw much harvesting of young timber for firewood, followed by (2) extensive infestations of the sugar maple borer in the late 30’s and 40’s, and (3) the disastrous hurricane of 1938 damaged much of the best sugarbush in the county. These factors seriously curtailed the production of maple syrup, and together with the establishment of several major wood using industries, furniture and smelter plants in or adjacent to the county, and a very severe ice storm in 1961 marked the final stages of depletion of the surviving maple stands of the county. There is an estimated 40,000 acres of forested land left in Hutingdon, but a great deal of this land is rough and rocky and of low productivity.
The northern part of the county contains the fertile and flatter lands where dairying is still the keystone of the economy. This activity is on the decrease, as everywhere else in Canada. In Quebec, the agricultural labour force was 12.5% in 1956, in 1965 it was only 6%. The 1961 census reports 1,133 farms in Huntingdon, of which 790 are classified as commercial (annual sales exceed $1,200). Many small family units are being consolidated into larger units or have been converted to nonagricultural uses, and recreation and residential holdings are steadily increasing. In the southern part of the county, apples and maple constitute important crops. There are around 200 orchards, with a crop valued in 1961 at close to $1,000,000, with at least 4,000 acres under cultivation and increasing. For the same year, there were 148 maple producers reporting 185,043 taps, or an average of 1,250 taps per producer, with a total production of 18,242 gallons of syrup valued at $68,000. However, because of the depletion effects of factors previously mentioned, both number of producers and quantity of maple products has been declining. I would estimate close to 100 producers in the county at the present time. Nevertheless, Huntingdon producers make up in quality and enterprise what they may lack in numbers. The county appears to be well situated to catch the early runs of sap, and regional differences are such that Franklin and district producers will be finishing sugaring before some of the northern and eastern counties have barely begun. This provides a substantial marketing advantage and Huntingdon county syrup is the first to be sold in the Province.
References
Census of Canada, 1961 Agriculture: Farm Woodlots. Catalogue 96-523. Dominion Bureau of Statistics, Ottawa.
Delisie, R., 1967 L’entaillage des êrables. Direction Generale des Bois et Forêts, Ministere des Terres et Forêts, Quebec.
Dominion Bureau of Statistics, 1967. Production of Maple Products 1967 and Value of Maple Products 1966. Catalogue 22-204. Minister of Trade and Commerce, Ottawa.
Quebec Bureau of Statistics, 1964, Maple Products. Department of Industry and Commerce, Quebec.
Taylor, R.D., J.K. Pasto and H. Southworth, 1967 Production Trends and Patterns of the Maple Syrup Industry in North America. Bulletin 742. The Pennsylvania State University, College of Agriculture, University Park, Pa.
Maple Sugar Making In 1858
Extension
Maple Syrup Digest
Vol. 6, No. 3
October 1967
REF# 131

In this issue, the Maple Syrup Digest would like to pay tribute to the AMERICAN AGRICULTURIST on its 125th anniversary. To do this, we ar reprinting some articles on maple syrup production which appeared in the January and February issues of the American Agricultgurist in the year 1858. The Digest is indebted to Linwood Lesure, Ashfield, Mass., Director and Past President of the National Maple Syrup Council, for sending us copies of these two issues which he found recently.
Although the following articles are antiquated now, they show that even “way back then” farmers were anxious to learn of new equipment and labor saving methods. The American Agriculturist has served as a means of communication for 125 continuous years, and to the publishers and editors we extend our most sincere congratulations.
The equipment and methods described in these letters are not necessarily approved by the editor of this publication. However, it was interesting and certainly should be to those of you who made sugar back “in the good old days”. ~Editor (photo)
From the January 1858, American Agriculturist
Experience In Maple Sugar Making
To the editor of the American Agriculturist:
As the season is approaching to commence operations in the “Sugar Camp” I will offer a few suggestions and plans gleaned from my observations and experience. It would seem that the process of making Maple Sugar is so simple that anyone possessed of the least “gumption” could not fail to make good, if not superior article, but such is not the fact, as the great amount of black and almost worthless stuff annually made abundantly proves.
lst. In tapping I use a 1/2 or 5/8 inch auger bit; and to “freshed” with, I use a follower, made something like an old fashioned “Pod auger” to make the hole about an eighth of an inch larger, and the same deeper, thus renewing or freshening the surface of the original hole.
The spout is made of sheet iron or tin, two inches wide and six to seven long, formed into a quarter circle, one end sharpened with a file or grindstone, and driven into the bark only, about ½ inch below the auger hole. Drive with a wooden mallet to prevent battering the spout. This is by far the best and cheapest spout that I have ever seen.
2nd. For buckets, I recommend those made of tin plate, to hold about three gallons, made a very little tapering, so that in the case of freezing the ice will slip out on the slightest thaw. Punch a hole in the bucket sufficient to receive the nail that is to be driven in the tree to hang it on, and it makes, par excellence, the best bucket for the purpose extant.
3rd. Boiling is done in sheet iron or copper pans, (not kettles) made as follows: Take a sheet of Russia iron, put a quarter or three-eighths inch iron rod in each end by tapping, or bending the iron around it. Let these rods be 16 or 18 inches longer than the width of the sheets. Have the ends of the rods flattened and a small hole punched, and bend them in such a manner that they be nailed to the boards, forming the sides of the pan, to serve as handles to lift with. When this is done, bend the sheets up at each end, nailing them to the sides which are boards about 1½ inches thick, to form a box 6 or 8 inches high, and they are ready for use. Then brick walls, or an arch as it is commonly called are built to accommodate as many of the pans as are needed, with two iron cross bars under the bottom of each pan to prevent their sagging, and straining the nailing too much. Set the pans level in mortar, and you have a boiling apparatus that will evaporate an amount of sap that will astonish those who have always boiled in kettles, and do the work much better than it can possibly be done in kettles, as there is no danger of burning or boiling over, this being prevented by the wooden sides. With three such pans, and good dry wood, one gallon of sap per minute can be evaporated.
With the above apparatus, and proper care in keeping everything connected with the camp clean, sugar can be made much superior to the best cane sugar that I have ever seen. The cost of buckets, with spouts, will be from 40 cents to 50 cents each. The pans, holding 35 gallons, will cost from $2.50 to $4.00 each.
R.H. Howard; Darke County, Ohio, Dec. 15, 1857
Remarks:
The above apparatus is a very perfect one, and may be adopted in detail in many camps. The only objection will be the expense of the buckets which will preclude their use in a majority of cases. We thank Mr. Howard for his early suggestions, and as maple sugar making will begin in the month of February, we solicit the experiences of sugar makers as soon as may be, in time for our next issue. Please help us to a page or so of good practical information on this topic. There are many interesting points, such as the best form and wood for troughs, buckets, side of tree to be tapped, height from the ground, size, form and depth of hole, carrying sap, boiling, clarifying, crystalizing, etc., etc., Ed. A.A.
From the February 1858, American Agriculturist
To the editor of the American Agriculturist:
In response to your solicitation for practical information relative to the making of sugar from the maple I offer my mite. It is well known that Maple Sugar is one of the staple productions of the Western portion of the “Southern Tier” of New York. The first premium awarded at the late State Fair, was given for an article made in Allegany County. In offering a statement of the process and implements used, I give those adopted and used by those that are engaged somewhat extensively in sugar making, and who make a very superior article.
In tapping, a 5/8 or 3/4 auger bit is used, making the hole 1½ or 2 inches deep. The spout is made of hard wood, four or five inches long, a hole bored with a small bit through its length, and turned in a lathe, one end to fit the hole made by the bit in the tree, and the other with a head, over which the wire loop attached to one edge of the bucket, is slipped and held. The end of the spout is made quite tapering, or “stunt” as it is sometimes termed, so as to fill the hole perfectly tight at its entrance in the bark of the tree. This allows all the sap to pass through the spout, and prevents its escape otherwise. To “freshen” another hole is bored and another spout inserted near the first, so that the same bucket receives the sap from both.
The buckets are usually made of pine, hooped with ash or iron, and sometimes the outside is painted. On one side at the upper edge of the bucket, a wire loop is inserted, just large enough to pass over the end of the spout after it is firmly driven into the tree, by which the bucket is hung. This dispenses with the sheet iron or tin spout, the gouge, and the nail. Many furnish covers to each bucket, which are made from blocks of pine, sawed of the proper length, from which thin pieces are riven with a shingle from. On one side or edge of these thin pieces a notch is cut, through which, when properly placed on the bucket, the sap drops from the spout. This cover excludes all rain and snow, leaves and bark. When the “Sugar Camp” is enclosed, (and all should be), and all kinds of stock excluded, the bucket should be hung near the ground, but otherwise, they may be hung out of the reach of sheep and swine, and reasonably from cattle.
The boiling is done in sheet iron pans, made by the tinner, usually of two or three sheets joined by rivets, the sides and ends turned up five inches, a heavy wire around the upper edge in the manner of a dripping pan. Iron loops are rivetted on at proper distances to serve as handles. Three of these pans placed on a well constructed arch, the two back pans placed each its height higher than the one immediately before it, small faucets placed in the two rear pans so that the back one may be discharged into the one next forward it, and that into the front one is found to be a great convenience.
A large store tub, placed so that it will stand its whole height above the upper or back pan, should be provided with a good cover, a good faucet and spout reaching from the tub to the pan. By the faucet and spout the sap may flow from the store tub to the upper pan, and from that to the second, and so to the third or front pan. The supply may be regulated by the faucets in each, so that the flow to all will be regular and sufficient. For gathering, a sled should be provided with a moderate sized tub firmly fastened upon it, which tub should have the upper head placed four or five inches below the upper end. Two 2 inch holes should be bored through this head. The discharge is through an 1¼ inch hole in the bottom of the gathering tub, by a spout reaching to the top of the store tub. The discharge from the gathering tub is closed by a long “plug” which passes through one of the 2 inch holes in the upper head into the 1¼ hole in the bottom. The spout from the gathering tub should be well made, with the end receiving the discharge tightly covered, and a hole through the cover large enough to receive the discharge and not waste. This spout is placed on the sled runner and easily and firmly secured.
When the season is somewhat advanced, the weather warm, and the buds begin to grow, it is often difficult to make sugar. This difficulty is obviated by putting a spoonful of quick time in each bucket. The sap again becomes sweet, and the syrup granulates freely and is quite as white and pleasant as ever. In “sugaring off” the syrup is carefully strained into a medium sized cauldron kettle and carefully reduced until it becomes sugar, some adding milk or other substances to “cleanse” and others rejecting it entirely. Indeed, when covers are used on the buckets, the gathering and store tubs, the pans well placed on a well constructed arch under cover, and the whole process conducted with the utmost neatness and order, the “cleansing process” is quite unnecessary.
The cost of bucket and spouts is $12½ to $15 per hundred, according to materials and workmanship; pans, $3 to $5 each, according to size, and quality of materials. Iron bound pine buckets are preferable to tin, and cost much less. The pans made entirely of iron, in the manner described, are far better than those with wood sides, less liable to leak, easier kept clean, sweeter, and more easy to handle. The cost for the same size and quality of iron is not materially more.
With this suit of apparatus, perfect cleanliness may attend the whole process, the sap and syrup are not stained, embittered, nor soured by a combination of sap, rain, snow, bark, leaves, buds, coal, and ashes. An article is readily and economically produced, almost rivaling the snow in whiteness and purity, pleasant to the sight, and exceedingly pleasant to the taste, as I hope you may have the opportunity of testing, when “Fair handed Spring unbosoms every grace.”
S.Scudder; Randolph, Cattaraugus Co., N.Y; Jan. 2, 1858
Further On Maple Sugar Making
To the Editor of the American Agriculturist:
My experience leads me to differ somewhat from your correspondent in the January Agriculturist. By using spouts made of pine, with a hole burned through, or sumach with the pith removed, and properly tapered at one end to fit the hole, I save the labor of retapping or “freshening,” for if the sun and air are well excluded from the interior surface it will not dry up or coat over; while tin or iron quarter circles, as recommended by Mr. H., leave the hole open and fully exposed to sun and air. The spout need not be more than three inches long if the buckets are hung up, except in case of using one bucket for two or more spouts, when longer ones will be useful. Pail handles, such as are ordinarily used on tin pails form excellent and very cheap spouts where they can be procured, and they might be turned to order to fit any required bit.
I prefer turned buckets of pine, or still better of cedar, the size of common water pails, fitted with a sheet iron ear” upon the outside, to hold it to the tree upon whatever is driven into it, for which I recommend a piece of 1/8 or 3-16 inch wire sharpened at one end. Properly ground, a wire can be driven into a tree without causing the too frequent “bleeding” which often follows where nails are used, and there is no head to catch the ear. This bleeding is not only an eye sore, but is very injurious to the tree, and lessens the quantity of sap secured. These buckets can be procured, painted and cared ready for use, at any pail factory, at a cost of from 15 to 18 cents each, and are superior to tin. in that they will stand much more rough usage and banging about, will last longer, and cost only one third as much.
Pans for boiling should be made of Russia iron bent up six inches all round, and stiffened with a 3/8 inch wire round the top; and wire handles can be affixed to suit. Such pans will not leak, whereas it is nearly impossible to nail or screw the iron bottom to wood sides and have it keep tight, trial has proved this. They cost but a trifle more than those with wooden sides, and it is always cheapest to get a good, reliable article, even at a double price, to say nothing of the vexation and loss of a continual sizzle when boiling. The wooden sides do not prevent boiling over; it is the absence of heat upon the sides, and an iron sided pan is safer if possible than one with wooden sides. In addition to this pan arrangement, it will be found highly advantageous to set kettles in the arch between the pans and the chimney, to use the heat which would be otherwise wasted in heating the sap preparatory to putting it into the pans. One who never used this arrangement will be astonished at the amount of time, wood and trouble saved by it; and kettles are not objectionable when the liquid is not allowed to stand in them. I advise setting the kettles higher than the pans, and having a metal faucet or cock inserted in them, and leading over into the pans, to save dipping the hot sap.
Great care should be taken to have the pans set exactly level; and in everything remember that “better not done than half done.” The supporting bars used by Mr. H., are not necessary where a genuine, whole pan is used.
In tapping I choose the north or west side of the tree, for this side will run when the south side will not, and will not cease running so soon in the season and will give more sap; of this latter I am confident. The trees should be tapped about four feet from the ground, with a ½ to ¾ inch bit, and two to three inches deep according to the size of the tree. Four feet high will be found a very convenient height (though the roots and limbs will yield liberally), for then in gathering, the bucket need not be removed from the wire, but merely tipped up and the contents collected very easily and rapidly. Also, if the buckets are set on the ground they catch many leaves blown by the wind, which is avoided by tapping high; and notice the fact that white sugar or syrup CANNOT be made from sap in which dead leaves have soaked , there is scarcely anything more deleterious.
Let “boxing” never be practiced. It is a barbarous and suicidal method, who would do it ought to be yoked up with him who kills bees for their honey, and placed on the dunce’s seat along side the old woman who killed the goose to get at the fountain of golden eggs.
If your “bush” is small and compact, the sap can be collected in pails with a “yoke”, but if large or scattered, and upon inclined ground, you will save much hard labor by making long spouts or troughs, and lay them in a line, with a tub or barrel at the head, into which you can turn your collection and let it run gradually through a faucet and along the small troughs to the reservoir, while you are gathering more. In my orchard I used three lines of troughs whose aggregate length was about a quarter of a mile, and the amount of back aches they saved is incalculable. These long troughs can be cheaply got by having a long log sawn into stuff two inches square, and then with a carpenter’s plough, a groove one inch wide, and 1¼ deep is easily made; widen the groove at the upper end, and lay them in a line as described, and having once used them you will not soon part with them.
When the sap is boiled to “syrup” set it away in tall wooden or glazed earthen jars to “settle;” let it remain two or three days, according to the thickness, perfectly still and undisturbed; then turn it slowly off, leaving the dregs to be mixed with hot sap and again settled till the sweetness is extracted. The clean syrup is then put in a pan, and to every pailful of syrup add a half teacup full of new milk, (a farrow cow’s milk will not answer) stir it well together while cold, and when still, build a slow fire; as it grows hot, a black cloud of scum will rise through the entire mass. which must be removed the moment it boils.
If for cakes or grained sugar, it is done when strings of it cooled on hard snow, or in cold water, will snap off like glass, then remove it from the fire and stir it incessantly till it begins to “grain” when the quicker it is in the plates, the better.
If for “grained” sugar keep on stirring till it is dry when it will look like fine coffee, or brown sugar, according to the care taken.
For “drained” sugar, take it from the fire, when it will “flake” off largely and freely in dropping from a tin skimmer, and get it away in tubs or glazed pots, for use. The purest of this will settle or crystalize, leaving the rest in thinnish molasses, containing nearly all the impurities. In a few months you will find the sides of the tubs coated with these crystals of sugar all shaped like an oblong house with one side of the roof longer than the other hard as glass, and of exquisite and almost immaculate purity. These crystals when melted over and remanufactured, possess a flavor peculiar to themselves, and quite distinct from ordinary maple sugar. Cakes made from these crystals are almost transparent, and are a rare curiosity, well worthy the young people’s efforts to make them.
A pint of old cider in a hogshead of sap will prevent it from graining; and sap so doctored can never be got beyond molasses. Also if syrup is allowed to “sour” and become “ropy” it will never cake or grain but can be made into candy, preserving the true maple flavor.
Excellent vinegar can be made from sap by boiling down one half, and putting it in a clean barrel with gauze or fine wire netting over the bunghole to keep flies and insects out. It will soon ferment and turn to vinegar preferable for some uses to the best cider vinegar. Having written too much already, I will only repeat the injunction that everything must be kept in perfect cleanliness if a nice and salable article is desired.
W.G. Wright; Hornellsville, Steuben Co., N.Y.; Jan. 1858
How To Clarify Maple Sugar
To the Editor of the American Agriculturist:
In the first place, the buckets should be made of good white pine or some other good clean material, and at the commencement of every sugar season, they should be carefully brushed out, to remove any dust or cobwebs that may have collected, then immersed in boiling water, washed thoroughly with a cloth, and rinsed with cold water. Storage and boiling apparatus should go through a similar operation.
The sap should be strained through woolen cloth and evaporated in sheet iron pans set in such a manner that the fire can only reach the bottom of the pan, and the chimney carried up outside the building so that no smoke or ashes can fall into the sap while boiling. The evaporation must be as soon after gathering as possible. The syrup must be passed through a woolen strainer when as thick as can be made to run through when cold. “Sugar off” in a pan made for the purpose. I use one made of the best Russia iron, three feet long, a little over two feet wide, and nine inches deep. A little sweet cream may be dropped in occasionally to keep it from boiling over.
When dry enough to retain its form well when taken from the moulds, (which may be known by stirring a little in a saucer till cold), pour it into an iron or brass kettle and stir till it begins to thicken considerably, and pour it in oblong moulds made of tin, and holding, say five pounds each.
When cold, take out of moulds and lay the glazed surface downward, which will prevent draining until you are ready for this operation. As the weather grows warm, or when ready, place the cakes of sugar on their edges in some convenient vessel to catch and retain the molasses, and if you do not have as nice sugar as can be made by any ordinary process, then I am no judge of the article.
I have tried clarifying with various substances, skimmed milk, saleratus and whites of eggs beaten together, etc., and I am satisfied, that where proper care is taken to keep everything sweet and clean, the sugar is clearer, pleasenter and every way better without any such additions.
Nearly all the impurities contained in common maple sugar, are either foreign matters which get in after the sap runs from the tree, or are caused by burning.
I ought, perhaps, to state that the buckets should be taken in immediately at the close of the sugar season, and go through a thorough washing and scalding process again, to remove every particle of sourness, and every other vessel used in the manufacture, should be cleansed immediately and laid away very carefully.
Now Mr. Agriculturist, perhaps some of your readers may think there is too much trouble in all this. Well, if they prefer to boil down a solution of ashes, smoke, snow, flies, and sour sap, and then partly remove the foreign matter by the use of some clarifier, all I have to say is, their taste differs from mine, enclosed is a small specimen of the sugar I manufactured by the above process last Spring. (The sample is as white and fine as the usual “Stuart’s refined” sold in the market. Ed.)
Wm. F. Bassett; Ashfield, Franklin Co., Mass.; Jan. 4th, 1858
The Drummonds Of Spencerville Maple Syrup Makers Since 1817
Extension
Maple Syrup Digest
Clarence F. Coons, Provincial Agroforestry Coordinator, Plant Industry Branch
Vol. 26, No. 1
February 1986
REF# 183
The original sugar bush reserved for tapping when the land was cleared about 1815 contained 6 acres and has been tapped continuously by the Drummond family since 1817. Today the Drummond sugar bush covers about 35 acres and each year 2600 taps are set out. It Is Ontario’s oldest continuous family maple operation.

Figure 1. Russ and Willis admire “the Drummond Giant”. This maple is 38 inches in diameter at 41/2 feet above the ground.
Around 1815, George Drummond began clearing and farming on Lot 37, Concession VI, Edwardsburgh Township, Grenville County. The land was part of a 3600 acre land grant given to his father, Colonel Peter Drummond, in 1804 following disbandment of the Loyalist Rangers Regiment at Quebec City. It was covered with a virgin mixed wood forest containing sugar maple, white elm, basswood, hemlock and white pine. About six acres of sugar maples were left for maple syrup production. In 1817 a log shanty was constructed and two iron kettles were hung.
Five Generations Of Syrup And Sugar Makers
George was killed in 1838 at the Battle of the Windmill near Prescott. With the assistance of a pension, his wife Catherine and young son Peter were able to continue farming. Peter’s eldest son, George, took over the farm in 1913 when his father died. George operated the farm until his death in 1933 when his sons, Russ and Willis took over. They operated it until 1970 when the present owner, George, bought the farm. It has been a Drummond tradition to alternately name the eldest son in each generation, Peter and George, making it a bit confusing to sort out the family tree.
While Russ and Willis operated the farm, they tapped 1800 each year. They also managed a dairy herd of about 45 holsteins, 100 apple trees and 3 acres of grapes. Their father had been an avid horticulturist and grew the finest fruit and vegetables in the area.
The present owner, George Drummond operates an Equipment Rental business in Ottawa. He had continued to modernize and streamline the operation to the extent that today it is one of Ontario’s most modern maple syrup operations.
The Sugarbush
Presently the sugar bush covers 35 acres. Each year 2600 taps are set out. The Drummond sugar bush has always been well known for its big sugar maple trees. The “Drummond Giant” stands majestically’ near the center of the woodlot. This huge patriot is 38 inches in diameter measured at breast height (41/2 feet above ground). Two others stand close by, one measuring 36 inches and the other measuring 35 inches in diameter at breast height.
Russ and Willis recall that their father and grandfather would never put more than one tap in each tree. That practice was abandoned when they took over in 1933. In 1933 their father took a trip to Florida and Russ and Willis headed to the bush to thin out the young trees that grew up in an old pasture field. They took out the yellow birch and the elm to give the sugar maples more growing space. Needless to say, when father returned home he was angered. The trees in this little grove today are growing well and are tapped each year. The pasture field had been cleared by their great grandfather about 1835. It was farmed for several years, then abandoned. The new growth appeared after their father stopped pasturing the woodlot. Present owner, George, is quite interested in continuing the job of thinning.
In the early days, since only dead and dying trees were cut, it was necessary to cut fuelwood in another bush to provide enough for boiling.
On July 18, 1905, a disaster struck the sugar bush. A hurricane toppled 274 large trees, many of them maples. It took a couple of years to clean up the fallen trees.
The Sugar Camps
Since 1817, there have been four sugar camps on the Drummond farm. The first was built in 1817 by the great grandfather of Russ and Willis. It was a log building containing two kettles. The sap was stored in an underground storage tank at this camp and pumped with a wooden storage trough in the sugar house. This trough was a hollowed white pine log. From there the sap flowed into the kettles. The Drummonds still have the kettles.

Figure 2. The second sugar camp. Picture taken in 1897.
The second sugar camp was located a few hundred feet southwest of the first. This camp was a much larger wood frame camp with ample room for wood storage. The camp was located at the edge of a slope so that the force of gravity could be used to transfer the sap from the gathering tank to the storage tank and then to the evaporator.
The 1900 this sugar camp was torn down and an even larger camp, 40 feet by 50 feet, was built. This larger camp provided storage for wood and approximately 1500 wooden buckets as well as four evaporators and a finishing stove. This sugar camp was a well-constructed building with a cement floor and was regarded at the time as one of the finest sugar camps in the area. It was used for 60 years.
In 1961 Russ and Willis built the fourth camp located on the same site as the previous two. It is a smaller building than the previous one but it houses all the modern maple syrup and sugar making equipment quite comfortably.
With its pleasant surroundings in the sugar bush, this neat and tidy sugar camp is certainly one of the most picturesque in the area.

Figure 3. The third sugar camp, built in 1901. Picture taken In 1909. Left to right: Willis Drummond, Jack Drummond, Will Gore and Jim O’Reilly (seated).
Sap Collection
At first, sap troughs were used on the Drummond farm. The trees were tapped with a tapping gouge which the Drummonds still have. About 1840 the first 100 wooden buckets were purchased from a local cooper in Spencerville Peter Drummond was so impressed with them that shortly after, he commenced making his own. The large buckets were made of white pine while the smaller ones were white cedar. Black ash was used for bands at first and later steel bands were used. Peter made the last wooden buckets on the farm about 1910. At that time they had about 1800 of them. Wooden spiles were made from elderberry.
About 200 wooden buckets were used by the Drummonds until 1969 on trees located across the Indian creek which passes through the woodlot. Because it was difficult to gather these trees after every run, the Drummonds found that during cold periods the sap would freeze and split the metal buckets They did not have this problem with the wooden buckets. Wooden gathering barrels and tanks and wooden gathering pails were also used for many years. In addition, large storage tanks were used to hold the sap at the sugar house. Gathering sap was always a big job in the early years but the family all helped. Occasionally neighbours and friends would be hired.
Before Russ and Willis took over in 1933, sap was never gathered or boiled on a Sunday. Their father, George, and grandfather, Peter, believed in strict adherence to observing Sunday as a day of rest.
Russ and Willis installed the first tubing in their bush in 1968. That year, 500 taps were set out on a gravity system. In 1969 a vacuum pump was installed utilizing a dumping unit made from a milk can. In 1972 two Surge milker pumps and a liquid release unit were installed. These two pumps have a capacity of 20 and 32 cubic feet per minute. They handled the sap satisfactorily for the 1600 taps on the system. George has had all main lines surveyed and levels have been established in the bush. He hopes to have all taps on tubing and vacuum in the near future.
Maple Syrup And Sugar Making
In the early days on the farm, maple sugar was the main product produced. There was a room in the Drummond house referred to as the “Sugar Room” and sale of maple sugar would continue throughout the year. Maple sugar was produced in the old iron kettle which swung into the fireplace in the sugar camp.
About two gallons of syrup would be placed in the kettle and boiled down into about 18 pounds of sugar. Hard sugar was produced in one half and one pound cakes and stored in barrels in the sugar room at the house. The Drummonds also made a soft sugar from the later sap runs. After 1920 the demand for maple sugar was not as great and only small amounts were made. In 1971 the Drummonds bought a new maple sugar making machine and started making sugar in quantity again. George’s wife, Marilynne, and Willis’ wife, Marjorie, made about 90 pounds of maple sugar last spring. It is sold as maple paddies, chiefly to school children who come to visit the camp.
Kettles were used first, then flat pans for making maple syrup. The Drummonds bought their first flue type evaporator in 1896. It was a Lightning 2 1/2′ by 10′ machine. Peter Drummond was so pleased with the operation of the machine that the following year he bought another. In 1899 he bought an evaporator 3 feet by 12 feet, followed by another of same size a few years later. These four evaporators were used until 1961.
The syrup was finished in a Lightning Star wood fired finishing pan 2 feet by 4 feet, purchased about the same time as the first evaporator. In 1961 when Russ and Willis built the present sugar camp they installed a new wood fired Lightning evaporator, 4 feet by 12 feet, which was used until 1970. In 1970 the arch was converted to oil for that year and covers were installed on the pans.
In 1971 a new oil fired Lightning covered evaporator, 5 feet by 16 feet, was installed along with a gas fired stainless steel finishing pan, 2 feet by 4 feet.
Maple syrup was always referred to as maple molasses in the early days. It was sold in 5 gallon cans that were made by a local tinsmith.
Maple Vinegar
Maple vinegar was made and sold at the Drummond Farm until about 1918. It was made from the sap obtained from the last runs which had a buddy flavor. The sap was boiled down to about one seventh its bulk. It was then removed from the evaporator and placed in white oak barrels.
A small quantity of good “mother of vinegar” or some old vinegar would be added. The barrels were then placed on their sides in the vinegar house with the bungs removed. A piece of screen was placed over the holes to keep out the flies. “Mother of Vinegar” is a slimy skin which forms on the surface of vinegar. It consists of a mass of bacteria which convert alcohol into acetic acid, the characteristic acid of vinegar.
The vinegar would be left in the vinegar house for about 15 months before it was sold in the summer and fall. The Drummonds produced 100 to 200 gallons of vinegar each year which they sold for 20 cents a gallon.
Sunday School Picnics
Each year during the latter part of the 19th century and until 1912, the Drummond sugar bush was the site of this happy occasion which took place in the latter part of August.
The picnic was the major social event of the local Union Sabbath Sunday School. Parents and children alike, came by the dozens for this well organized event. Peter Drummond, the owner of the sugar bush at the time, was librarian and superintendent of the local Sunday School for 62 years,
Late August was the most appropriate time of year for the picnic since, the mosquitoes and flies had disappeared from the bush, the weather was still warm, and the hay fields where many of the events took place had been harvested.
Each year, a stage was set up in the sugar bush and entertainment was provided by a guest speaker. Occasionally the Spencerville Brass Band would attend. There was a huge swing suspended from a towering maple for the children as well as games and races. There was baseball, lacrosse, football and cricket in adjacent fields for the teenagers and adults. Roast beef, veal, mutton and chicken pie were commonly part of the menu. In 1887 the picnic admission charge, which covered two meals and all events, was 10 cents for those who assisted in providing for the event and 25 cents for others.
Russ recalls a momentous occurrence in 1903 when an unexpected visitor from nearby New York state arrived driving an automobile. It was the first opportunity for many to see a horseless carriage. Upon its arrival, the baseball and football games immediately stopped, the music ceased and men, women and children all rushed excitedly towards the sputtering vehicle. The car was a 1903 two-cylinder Ford Touring car, painted bright red and elegantly upholstered in leather.
The annual picnic was an occasion to hitch up your best horse to your best buggy, to meet your friends and neighbours, to participate in sporting events, to hear the finest music in the countryside echo throughout the sugar bush and to enjoy the biggest feast of the year. The Drummonds fondly remember many of the picnics.
The lore of the sugar bush, the nostalgia surrounding the boiling, and the joyous and eventful “Sugaring-off” parties have given the Drummond sugar bush a distinction in the community dating back many generations.
Today, although modern methods of syrup production are followed, this same distinction continues as busloads of school children and carloads of adults come to witness and enjoy the “Drummond Way of Life”, a way of life for 157 years on the Drummond farm.
Part B: The Maple Resource
North American Maple Resource
L’érable à sucre : Caractéristiques, écologie et aménagement
Extension
Ressources naturelles Canada, Service canadien des forêts
Gouvernement du Québec, Ministère des Ressources naturelles, Ministère de l’Agriculture, des Pêcheries et de l’Alimentation
1995
REF# 400
Note: Les figures ne sont pas disponibles dans l’infobase.
Préambule
Au Québec, l’érable à sucre est un des feuillus les plus estimés, un feuillu noble. Ceux qui, l’automne, ont le loisir de se promener dans les érablières gardent un souvenir impérissable du spectacle coloré qu’ils ont admiré. Ces merveilleux paysages sont une source de paix et de joie pour des milliers de Québécois et de touristes, un des symboles les plus universels du territoire et de la culture propre qu’il a engendrée.
Au printemps, les premières coulées de sève marquent le début d’une nouvelle saison d’activités; le «temps des sucres» engendre un revenu d’appoint important et structurant pour l’économie des régions. Au cours des dernières années, de nouvelles méthodes de régie et d’exploitation acéricoles ont favorisé le développement d’un secteur de production spécialisée dont les recettes sont de l’ordre de cent millions de dollars par année; plus de la moitié de cette production est exportée partout à travers le monde.
Le bois de l’érable à sucre est solide et résistant; il sert surtout à la fabrication de meubles et de parquets, aux placages et contreplaqués; il a un rendement calorifique élevé, ce qui en fait une essence très recherchée comme bois de chauffage. Près du quart du volume marchand brut de la forêt feuillue, qui elle-même constitue plus de 30 % de toute la production ligneuse, est composé d’érable à sucre. L’exploitation de l’érablière joue ainsi un rôle significatif en assurant une occupation viable et durable du territoire et le développement d’une ruralité plus forte et plus dynamique.
Depuis longtemps, la communauté scientifique québécoise a accordé à l’acériculture et à la gestion de cette ressource forestière une attention particulière. Mais c’est l’épisode spectaculaire du dépérissement au début des années 1980 qui a tout à coup attiré l’attention du public et provoqué une activité accrue de recherche et d’information, proportionnelle à l’importance économique et patrimoniale de l’érable à sucre.
C’est en 1992 que M. Fernand Pagé, du Service des sols de la Direction de la recherche et du développement agro- alimentaire du ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec, prenait l’initiative de réunir des chercheurs, afin de préparer un manuel sur l’érable à sucre. La Direction de la recherche forestière du ministère des Ressources naturelles du Québec mandatait Mme Linda Drouin, de la Division du transfert de technologie de ce même ministère, pour coordonner la rédaction des textes qui constituent le présent document. Le Centre d’enseignement et de recherche en foresterie de Sainte-Foy (CERFO) a ensuite été chargé de la mise en page et de l’édition de l’ouvrage.
Les auteurs ont été recrutés parmi les spécialistes du Centre de Recherche acéricole (CRA), de plusieurs ministères québécois et fédéraux et des universités. Ce groupe, finalement composé de 30 personnes, s’était donné comme objectif de «synthétiser et regrouper les informations scientifiques de base… à des fins de productions acéricole ou de matière ligneuse», en vue d’éventuellement «confectionner, à partir de ces informations, des guides techniques … » Ce manuel a donc été conçu comme un outil de consultation utile aussi bien aux enseignants, aux chercheurs et aux spécialistes en aménagement qu’aux industries, groupements forestiers, bureaux de consultants, syndicats et offices de producteurs.
Remerciements
Des remerciements sincères s’adressent aux auteurs et à tous ceux qui, de près ou de loin, ont participé à la réalisation de cette belle aventure.
Madame Colette Ansseau, écologiste forestière, Ph.D. , Département de biologie, Université de Sherbrooke
Monsieur Bady Badibanga, ing.f., M.Sc., Ph.D., École de sciences forestières, Université de Moncton
Monsieur Éric Bauce, ing.f., M.Sc., Département des sciences forestières, Pavillon Abitibi Price, Université Laval
Madame Hélène Bernier, biologiste, Département de biologie, Université de Sherbrooke
Madame Annick Bertrand, biologiste, M.Sc., Ph.D., Centre de foresterie des Laurentides, Ressources naturelles Canada
Monsieur Normand Bertrand, biologiste, Direction de l’environnement forestier, Ministère des Ressources naturelles
Madame Francine Bigras, biologiste, Ph.D., Centre de Foresterie des Laurentides, Ressources naturelles Canada
Monsieur Jean-Marc Boivin, technicien forestier, Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Gilles Bonneau, entomologiste forestier, Direction de la conservation, Ministère des Ressources naturelles
Monsieur Robert Boutin, ing.f., M.Sc., Centre de Foresterie des Laurentides, Ressources naturelles Canada
Monsieur Jean-Louis Brown, ing.f., Ph.D., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Claude Camiré, ing.f., Ph.D., Faculté de foresterie et de géomatique , Université Laval
Monsieur Jean-Pierre Carpentier, ing.f., M.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Marcel Darveau, ing.f., M.Sc., Département de biologie, Faculté des sciences et de génie, Université Laval
Madame Maryse Dubé, agronome, Direction de l’environnement forestier, Ministère des Ressources naturelles
Monsieur Gilles Gagnon, ing.f., M.Sc.f., Direction de la recherche forestière, Ministère des Ressources naturelles
Maurice Gagnon, technicien forestier, Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Michel Huot. ing.f., M.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Zoran Majcen, ing.f., M.Sc., D.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Yves Maufette, biologiste, Département des sciences biologiques, Université du Québec à Montréal
Monsieur Denis Ouellet, ing.f., Ph.D., Centre de Foresterie des Laurentides, Ressources naturelles Canada
Monsieur Roch Ouimet, ing.f., M.Sc.f., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Fernand Pagé, Ph.D., Services des sols, Ministère de l’Agriculture, des Pêcheries et de l’Alimentation
Monsieur David. Paré, ing.f., Ph.D., Biodôme de Montréal
Monsieur David Pothier, ing.f., M.Sc., Ph.D., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur André Rainville, ing.f., M.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Yvon Richard, ing.f., Ph.D., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Denis Robitaille, ing.f., M.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Gilles Robitaille, biologiste, Ph.D., Centre de Foresterie des Laurentides, Ressources naturelles Canada
Monsieur Gabriel Roy, ing.f., M.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Madame Annie Sauvesty, physiologiste, Ph.D., Services des sols Ministère de l’Agriculture, des Pêcheries et de l’Alimentation
Monsieur Michel Thibault, ing.f., M.Sc., Direction de la recherche forestière, Ministère des Ressources naturelles
Monsieur Jacques Trencia, ing.f., Ph.D., Centre de Foresterie des Laurentides, Ressources naturelles Canada
Partie I L’érable à sucre
1 Caractéristiques de l’érable à sucre
1.1 Position taxonomique et biogéographique de l’erable à sucre
Colette Ansseau et Hélène Bernier
1.1.1 L’érable à sucre, le genre Acer et les Acéracées
La position taxonomique des érables est établie en fonction des diverses composantes de ces espèces, le caractère propre de chacune de ces composantes étant défini par la classification des végétaux.
Tout d’abord, les érables font partie des plantes supérieures qui constituent le groupe des phanérogames (du grec phaneros, visible et gamos, mariage) ou plantes à fleurs qui, elles-mêmes, relèvent des rhizophytes (du grec rhiza, racine) ou plantes vasculaires. Ces dernières se nomment ainsi principalement parce qu’elles possèdent des racines et un appareil conducteur (faisceaux de xylème et de phloème) qui permet la circulation des liquides ou sèves (Guignard, 1986).
Pour définir les phanérogames avec plus de précision, étant donné la grande variété des structures de la fleur, on les distingue davantage par la présence d’une graine. Ce groupe porte alors le nom de spermaphytes ou spermatophytes (du grec sperma, graine et phyton, plante) (Deysson, 1979).
L’embranchement (ou division selon Marie-Victorin, 1977) des spermaphytes se divise en deux sous- embranchements (ou sous-divisions selon Marie-Victorin, 1977): les gymnospermes et les angiospermes. Chez les gymnospermes (du grec gymnos, nu), l’organe reproducteur femelle, l’ovule, est nu, de même que la graine; c’est le cas des arbres résineux. Par contre, chez les angiospermes (du grec aggeion, petite urne), dont les érables font partie, l’ovule est situé à l’intérieur d’un organe clos, l’ovaire, dont les parois sont formées par une ou plusieurs feuilles carpellaires ou carpelles (Guignard, 1986). La graine des angiospermes se forme à l’intérieur d’un fruit (Deysson, 1979).
Les angiospermes se subdivisent ensuite en deux classes définies par un caractère embryonnaire constant, le nombre de cotylédons (distinction faite la 1ère fois en 1789 par J. Ray et de Jussieu [in Deysson, 1979]), c’est-à- dire les premières feuilles de l’embryon que porte la plantule. Ce sont les monocotyles (ou monocotylédones) et les dicotyles (ou dicotylédones). Les érables font partie de la classe des dicotyles (figure 1.1).
Figure 1.1 Classification taxonomique des érables (Acer)
Les dicotyles possèdent d’autres traits spécifiques qui les différencient des monocotyles, par exemple le type floral pentamère ou tétramère (c’est-à-dire que les pièces de chacun des quatre verticilles de la fleur sont par cinq, plus rarement par quatre, ou multiples de ces nombres), ou encore la nervation réticulée des feuilles (Marie-Victorin, 1977). Les verticilles de la fleur sont le calice composé des sépales, la corolle avec ses pétales, l’androcée (organe mâle) constitué des étamines et, finalement, les carpelles (pièces florales qui portent les ovules) représentant une des parties du gynécée (organe femelle).
Chez les dicotyles , on distingue trois sous-classes selon les caractères de la corolle: les apétales (corolle absente), les dialypétales (pétales libres, du grec dialusis, séparation) et les gamopétales (pétales soudés). La sous-classe des dialypétales est constituée de plantes à pétales libres ou indépendants les uns des autres. Elles ont, en principe, des fleurs complètes et bisexuées, avec périanthe (ensemble de l’enveloppe florale) différencié en calice et corolle. Les pièces des verticilles successifs alternent régulièrement (Deysson, 1979).
Les dialypétales représentent plus de 70 000 espèces réparties en trois séries. Les érables sont classés dans la série des disciflores, car ils possèdent un réceptacle floral plan ou convexe, surmonté d’un disque nectarifère. Les carpelles sont placés sur ce disque ou enfoncés dans sa masse (Deysson, 1979).
Le disque nectarifère étant extraséminal (position du disque par rapport aux étamines), les érables se classent dans l’ordre des sapindales, bien que Marie-Victorin (1977) situe la famille des acéracées dans l’ordre des térébinthales. De leur côté, Cronquist (1981), Holmes (1983) et Takhtajan (1986) regroupent les sapindales et les rutales dans l’ordre des térébinthales.
Chez les plantes de l’ordre des sapindales, l’androcée est généralement diplostémone, (du grec diploos, double et du latin stamen, étamines), c’est-à-dire qu’il y a deux fois plus d’étamines que de pétales et qu’elles sont disposées en deux verticilles (Guignard, 1986). Le gynécée est formé de deux à trois carpelles soudés en un ovaire pluriloculaire à un ou deux ovules apotropes par loge (Deysson, 1979).
Les diverses familles des sapindales sont par la suite classées selon la symétrie de la fleur. La famille dont il sera question dans ce document, celle des acéracées, présente des fleurs actinomorphes, les pièces florales étant symétriques par rapport à un axe.
La famille des acéracées (Aceraceae) comprend deux genres: dipteronia (deux espèces en Asie centrale) et Acer qui comprend, selon différents auteurs, de 100 à 200 espèces connues (Marie-Victorin, 1977; Harlow et al., 1978; Mabberley, 1987). Seules treize espèces d’Acer sont indigènes en Amérique du Nord, dont dix au Canada (Fowells, 1965; Harlow et al., 1978; Hosie, 1980; Cronquist, 1981; Little, 1984; Radford, 1986).
Caractéristiques des Acer L.
Ce sont des arbres ou des arbustes. Leur bois dur et résistant est recherché pour la fabrication de meubles, de parquets, de boiseries, de contreplaqués et de menus articles.
Leurs feuilles sont caduques, c’est pourquoi on les place parmi les essences caducifoliées. Ces feuilles sont opposées, simples palmilobées ou composées pennées, sans stipules (petits appendices foliacés qui se trouvent à la base du pétiole de la feuille, selon Parent, 1990) (figure 1.2).
Figure 1.2 Caractéristiques des Acer (ex.: érable à sucre)
Les fleurs sont régulières (actinomorphes), hermaphrodites (mâle et femelle à la fois) ou unisexuées et pentamères (pièces en multiples de cinq) avec cinq sépales et cinq pétales, bien que la corolle soit parfois sans pétales. Les étamines sont souvent réduites à huit au lieu de cinq ou dix. Le pistil a deux carpelles soudés et biovulés. Les inflorescences sont des grappes pendantes ou dressées, des glomérules latéraux ou des corymbes (Marie-Victorin, 1977; Deysson, 1979).
Les fruits sont des samares ailées, réunies par deux à la base (double samare) et uniséminées (une graine par samare). Les graines n’ont pas d’albumen, petite masse de substances de réserve (amidon, etc.) entourant souvent l’embryon dans la graine des angiospermes (Marie-Victorin, 1977), ni d’arille, bourrelet hypo-ovulaire qui recouvre plus ou moins complètement la graine (Parent, 1990).
Il existe plusieurs espèces d’érables au Québec qui, en plus de leurs noms ,scientifiques, sont connues aussi par des noms vernaculaires ou populaires. Rappelons que le mot Acer vient du celte ac, qui signifie dur, faisant référence à la dureté du bois (Harlow et al., 1978; Hosie, 1980). Voici la liste des noms scientifiques avec leur origine grecque ou latine, les noms français officiels, les noms populaires et les noms anglais des érables du Québec.
Acer saccharum Marsh.:
saccharum: veut dire doux ou sucré; vient du sanscrit sarkarà, signifiant sable ou sucre, qui a donné le mot grec sakcharon, désignant la sève sucrée des noeuds de Bambou (Harlow et al., 1978; Hosie, 1980);
érable à sucre; érable franc, érable franche, érable sucrier, érable dur, érable du Canada, érable piqué, érable moiré, érable ondé (Marie-Victorin, 1977; Lauriault, 1987);
sugar maple, bird’s-eye maple, curly maple, bard maple, head maple, rock maple, sugartree, sweet maple (Fowells, 1965; Marie-Victorin, 1977; Little, 1984; Lauriault, 1987).
Acer rubrum L.:
rubrum: du latin, signifie rouge; ainsi nommé en raison de la couleur rouge de ses rameaux, bourgeons, fleurs, fruits et pétioles ainsi que de son feuillage d’automne (Harlow et al., 1978; Lauriault, 1987);
érable rouge; plaine, plaine rouge, érable tendre, plane rouge (Marie-Victorin, 1977; Lauriault, 1987);
red maple, curled-maple, scarlet maple, soft maple, swamp maple, water maple, Carolina red maple, white maple (Fowells, 1965; Marie-Victorin, 1977; Harlow et al., 1978; Little, 1984; Lauriault, 1987).
Acer saccharinum L.:
saccharinum: idem saccharum (Hosie, 1980);
érable argenté; plaine blanche, plaine de France, érable blanc, érable à fruits cotonneux, plane blanche, (les qualificatifs blanc et argenté font référence au dessous blanchâtre des feuilles) (Marie-Victorin, 1977; Lauriault, 1987);
silver maple, white maple, river maple, soft maple, silverleaf maple, swamp maple, water maple (Fowells, 1965; Marie-Victorin, 1977; Little, 1984; Lauriault, 1987).
Acer spicatum Lam.:
spicatum: vient de spica en latin, pointe ou épi; fait allusion à ses fleurs en grappes dressées (Harlow et al., 1978; Hosie, 1980; Lauriault, 1987);
érable à épis; plaine bâtarde, érable bâtard, bâtarde, plaine, fouéreux, plaine bleue, plaine bâtarde (Marie-Victorin, 1977; Lauriault, 1987);
mountain maple, dwarf maple, low-moose maple, whitewood (Nouveau Brunswick), whiterod, white maple, moose maple (Marie-Victorin, 1977; Little, 1984; Lauriault, 1987).
Acer nigrum Michx. f.:
nigrum: signifie noir ou foncé en latin; ainsi nommé en raison de la couleur vert foncé de son feuillage et gris noirâtre de son écorce (Harlow et al., 1978; Lauriault, 1987);
érable noir; aucun autre nom;
black maple, black sugar maple, bard maple, rock maple, sugar maple (Fowells, 1965; Marie-Victorin, 1977; Little, 1984; Lauriault, 1987).
Acer pensylvanicum L.:
pensylvanicum: signifie de Pennsylvanie; l’orthographe avec un seul «n» rappelle une vieille façon d’écrire le nom de l’ancienne colonie (Hosie, 1980);
érable de Pennsylvanie; bois d’orignal, bois barré, bois noir, érable strié, érable jaspé (Europe), érable barré (Marie- Victorin, 1977; Lauriault, 1987);
striped maple, moosewood ou moose wood (tiré de l’algonquin «mousou» qui signifie mangeur de branches), goosefoot maple (à cause de la ressemblance de la feuille avec une patte d’oie), moose maple, whistlewood (Marie- Victorin, 1977; Little, 1984; Lauriault, 1987).
Acer negundo L.:
negundo: nom indigène du gattilier de l’Inde; utilisé dans le cas de l’érable à Giguère en raison de la ressemblance de ses feuilles avec celles du gattilier (Hosie, 1980);
érable négondo; érable à Giguère, érable argilière, aune-buis, érable à feuilles de frêne, érable du Manitoba, frêne à fruits d’érables, plaine à Giguère, plaine négundo (Marie-Victorin, 1977; Lauriault, 1987);
boxelder (à cause de la ressemblance du feuillage avec les Sambucus [elders] et le bois blanchâtre du Buxus sempervirens L. [Box]), ash-leaved maple, ashleaf maple, Manitoba maple (Marie-Victorin, 1977; Little, 1984; Lauriault, 1987).
Acer platanoides L.: (espèce introduite, originaire d’Europe)
platanoides: ayant l’aspect d’un platane; du grec platys, large et oides, semblable à (Hosie, 1980);
érable platanoïde (Marie-Victorin, 1977); érable de Norvège, érable plane, plane (Marie-Victorin, 1977; Lauriault, 1987);
Norway maple (Marie-Victorin, 1977; Little, 1984; Lauriault, 1987).
1.1.2 Répartition du genre Acer et aire de distribution de l’érable à sucre
À l’échelle mondiale, les nombreuses espèces du genre Acer se répartissent largement dans tout l’hémisphère nord mais, étant donné que le foyer du genre est l’Asie orientale, c’est dans l’est de l’Himalaya et dans la Chine centrale qu’elles se retrouvent le plus abondamment.
Dans l’Ancien monde, les érables s’étendaient du sud des montagnes de java à l’Afrique du Nord tandis que dans le Nouveau monde on les retrouve de l’Alaska et du Canada jusqu’aux montagnes du Guatemala.
La répartition des espèces végétales dépend de plusieurs facteurs fondamentaux, notamment les gradients climatiques issus de la latitude, de la continentalité et du relief (Richard, 1987). À ces gradients sont liés plusieurs facteurs environnementaux comme les températures moyennes saisonnières, le nombre de degrés-jours de croissance essentiels au développement des végétaux, la durée de la saison de croissance et la quantité de précipitations. La végétation varie aussi en fonction du type de sol. Les sols les plus répandus au Québec-Labrador sont les podzols, bien que les brunisols se rencontrent fréquemment dans le sud du Québec, particulièrement dans les érablières.
Le territoire du Québec-Labrador présente des variations climatiques importantes du nord au sud. La température moyenne passe de -8 °C au nord, où règne le permagel, à 7 °C au sud, dans la région de Montréal et en Laurentie méridionale (Wilson, 1971 in Richard, 1987). Le nombre de degrés-jours de croissance au-dessus de 5 °C, seuil de l’activité végétative, varie de 200 au nord à 1900 au sud, alors que la saison de croissance est de 40 jours en moyenne au nord et de 180 à 200 jours au sud dans la région de Montréal et la vallée du Richelieu (Richard, 1987).
L’ensemble de ces paramètres, la diversité des conditions climatiques locales et des facteurs comme les feux, les chablis et les épidémies expliquent, pour une bonne part, la grande diversité des communautés forestières du Québec.
Répartition du genre Acer
La carte reproduite à la figure 1.3 a été tirée de la Flore laurentienne du Frère Marie-Victorin (1977). Elle indique la limite nord, sur le territoire du Québec, des espèces laurentiennes d’érables: Acer spicatum (érable à épis), Acer rubrum (érable rouge), Acer saccharum (érable à sucre), Acer Pensylvanicum (érable de Pennsylvanie), Acer saccharinum (érable argenté) et Acer nigrum (érable noir).
Figure 1.3 Répartition du genre Acer au Québec
La végétation du Québec-Labrador peut être classée grossièrement, du nord au sud, en quatre grandes formations: la toundra, la taïga, la forêt coniférienne et la forêt caducifoliée. La forêt mixte, qui fait la transition entre les deux dernières, peut être considérée comme une cinquième formation. Dans les grandes formations forestières, on distingue des domaines climaciques caractérisés chacun par un type de groupement forestier qui représente l’optimum de développement de la forêt, compte tenu des caractéristiques du climat régional. Dans la forêt coniférienne, ces domaines sont ceux de la pessière à cladonies dans la taïga, puis, plus on progresse vers le sud, de la pessière à mousses hypnacées, de la sapinière à épinette noire, de la sapinière à épinette blanche et de la sapinière à bouleau blanc. Les domaines de la sapinière à bouleau jaune et de la sapinière à érable rouge peuvent être considérés comme appartenant à la formation de la forêt mixte. La formation de la forêt feuillue est restreinte au sud du Québec et les domaines climaciques qu’on y distingue sont ceux de l’érablière à bouleau jaune, de l’érablière à tilleul d’Amérique et de l’érablière à caryer cordiforme (Grandtner, 1966; Thibault, 1985; Richard, 1987; Ansseau et Grandtner, 1988) (figure 1.4).
Figure 1.4 Schéma des principales zones de végétation au Québec
Dans l’ensemble des domaines des érablières, l’érable à sucre domine souvent le paysage. Ces domaines couvrent environ 120 000 km carrés au sud du Québec (Dansereau, 1943, 1946; Dansereau, 1959 in Richard, 1987). Ils se répartissent, de part et d’autre de la vallée du haut Saint-Laurent, selon un gradient nord-est sud-ouest qui est imprimé par la combinaison des variations latitudinales et altitudinales. C’est ainsi qu’on retrouve d’abord le domaine de l’érablière à bouleau jaune dans les piémonts des Laurentides et des Appalaches, grosso modo entre 350 et 750 m d’altitude, puis le domaine de l’érablière à tilleul jusque vers 200 m d’altitude et finalement celui de l’érablière à caryer dans les basses terres (Ansseau et Grandtner, 1988).
Même si les domaines des érablières sont surtout dominés par la présence de l’érable à sucre, on retrouve des érables dans presque tous les biomes forestiers.
L’érable à épis est en effet présent dans la plupart des domaines, à partir de celui de la pessière à mousses hypnacées jusqu’à celui de l’érablière à bouleau jaune. C’est une espèce plutôt exigeante du point de vue nutritif et elle y occupe spécialement des sites mésophiles (Richard, 1987). L’érable de Pennsylvanie, pour sa part, se retrouve dans la sapinière à épinette blanche, la sapinière à bouleau jaune, la sapinière à érable rouge, ainsi que dans l’ensemble des érablières méridionales. On l’y retrouve surtout dans des sites mésophiles (Richard, 1987).
L’érable rouge et l’érable à sucre apparaissent, en venant du nord, d’abord dans le domaine de la sapinière à bouleau jaune, mais ils y sont toutefois à la limite nord de leur aire de distribution. On les retrouve tous deux dans des sites mésophiles, mais plutôt dans des peuplements perturbés pour le cas d’Acer rubrum. L’érable rouge ne forme des groupements stables que sur des sites trop peu propices à l’érable à sucre, notamment des sites hygrophiles ou des escarpements rocheux. C’est donc l’érable à sucre qui constitue l’espèce dominante dans les peuplements stables d’érables de ce domaine. Il y préfère toutefois les stations les plus thermophiles (Richard, 1987).
Dans le domaine que Richard (1987) qualifie de sapinière à érable rouge, A. rubrum représente une des espèces dominantes ou codominantes dans des sites mésophiles. Et «l’érable à sucre y forme de petits peuplements discontinus en bordure des Laurentides sagamiennes» (Richard, 1987).
Les érablières à bouleau jaune, à tilleul d’Amérique et à caryer cordiforme constituent les demeures par excellence de l’érable à sucre au Québec. L’espèce y est dominante sur les stations mésiques dans les peuplements stables. L’érable rouge s’y rencontre aussi comme dominant ou codominant, mais dans des peuplements perturbés.
De plus, l’érable négondo (A. negundo) et l’érable argenté viennent s’ajouter à la liste des espèces d’érables, sur les rivages inondés au printemps, dans les domaines de l’érablière à tilleul d’Amérique et de celle à caryer.
L’érablière à caryer cordiforme elle-même s’enrichit de l’érable noir, de l’érable argenté et de l’érable négondo. Le premier dans les sites calcicoles, basiphiles et mésophiles où il domine au stade de climax. Le deuxième, l’érable argenté, est nettement hygrophile et peut également dominer des climax stationnels. L’érable négondo, quant à lui, se rencontre plutôt dans les peuplements perturbés en rivage des cours d’eau.
Aire de distribution de l’érable à sucre
Bien qu’il existe environ 150 espèces d’érables dans le monde, l’érable à sucre se retrouve exclusivement en Amérique du Nord (Lauriault, 1987). Il constitue l’espèce dominante des domaines de l’érablière à caryer cordiforme situés dans les régions de l’ouest de la Laurentie, de la Montérégie et du HautRichelieu, de l’érablière à tilleul d’Amérique (érablière laurentienne de Grandtner, 1966) qui couvre la Laurentie, les basses Laurentides, l’Estrie piémontaise et les Montérégiennes et, finalement, de l’érablière à bouleau jaune dans les Laurentides, l’Estrie, la Beauce, la Côte-du-Sud, la Baie-des-Chaleurs, le Bas-Saint-Laurent, les îlots d’érablières en Gaspésie, en Abitibi et en Sagamie (Richard, 1987).
En considérant les territoires de l’est des États-Unis et du Canada, l’érable à sucre s’étend de la Nouvelle-Écosse en passant par le Québec, le sud-est et le sud-ouest de l’Ontario jusqu’à l’extrême sud-est du Manitoba.
Sa limite ouest américaine se situe dans l’ouest du Minnesota, à peu près au centre de l’Iowa et dans l’est du Kansas. Au sud, sa limite longe la frontière sud du Missouri, descend au sud du Tennessee et se termine dans le nord de la Georgie. Elle traverse par la suite l’ouest de la Virginie et atteint l’Atlantique à partir du New Jersey pour remonter jusqu’en Nouvelle-Écosse.
Les états des Grands Lacs, l’Ohio, la Pennsylvanie, l’état de New York, la Nouvelle-Angleterre, le sud des Appalaches et du Canada renferment les peuplements d’érable à sucre les plus importants (Fowells, 1965). Cette espèce est par contre absente dans la partie sud de la côte Atlantique et dans les plaines côtières du golfe du Mexique, cette zone appartenant plutôt à l’aire de distribution d’une espèce très ressemblante à l’érable à sucre, l’érable de Floride (Acer barbatum) (Fowells, 1965).
Acer saccharum, dans la plus grande partie de son aire de distribution, se développe le mieux sur les sols frais également humides et riches (Harlow et al., 1978; Hosie, 1980; Ministère de l’Énergie et des Ressources (MER), 1980). Il tolère très bien l’ombre (Lauriault, 1987) et se régénère donc facilement sous son propre couvert, ce qui maintient la stabilité des peuplements. Dans le sud du Québec, c’est sur les premiers contreforts des Appalaches, dans la région des Bois-Francs qu’il atteint son plus grand développement (Marie-Victorin, 1977).
1.1.3 La reconquête post-wisconsinienne du Québec: des glaciers au sirop d’érable en 12 000 ans
Les communautés végétales telles qu’on les perçoit aujourd’hui résultent de transformations à l’échelle des temps géologiques. La dynamique du couvert végétal fonctionne à un tout autre rythme que le nôtre.
Tout comme la rotation de la terre, les changements qui s’opèrent dans les combinaisons biogéographiques de la planète ne sont guère perceptibles à l’oeil humain.
La paléophytogéographie donne maintenant la possibilité d’étudier de plus près le pollen, les spores, les graines, les feuilles, les rameaux et les bourgeons qui ont «dormi», parfois pendant des milliers d’années, au sein de sédiments de lacs ou de tourbières. La combinaison des datations que l’on peut déduire de ces études permet de reconstituer la composition de la végétation et son évolution dans l’espace et dans le temps.
Le relief du Québec-Labrador est composé «de vieilles plates-formes disséquées, rabotées par les glaciers du Pléistocène» (Richard, 1987). Les glaces recouvraient entièrement le Québec-Labrador au Wisconsinien Supérieur (période de glaciation datant d’environ 12 500 ans [Landry et Mercier, 19841). Il y a 18 000 ans, toute la surface au nord de la latitude de New York était revêtue d’un vaste glacier continental d’épaisseur kilométrique, l’inlandsis. Quelque 3 000 ans plus tard, la glace fond, libérant le golfe du Saint-Laurent. La mer peut alors s’avancer dans l’estuaire, niais les calottes glaciaires gaspésiennes au sud et laurentienne au nord, demeurent (Richard, 1987). Quatre mille ans s’écoulent avant que n’apparaissent les terres au sud des Laurentides. Le glacier fait alors place à la mer de Champlain sur toutes les basses terres du Saint-Laurent jusqu’aux Appalaches (Richard, 1987).
Vers 9 000 ans avant nos jours, l’inlandsis demeure sur le plateau laurentien loin au nord tandis que l’eau douce remplace la mer sur le territoire de la Laurentie au sud. On nomme cette étendue d’eau douce, le lac à Lampsilis. L’île de Montréal apparaît 7 500 ans avant l’actuel et les glaces disparaissent définitivement vers 5 500 ans avant nos jours (Richard, 1987).
La colonisation végétale postglaciaire s’est faite généralement du sud au nord et des côtes vers l’intérieur des terres (Richard, 1987).
La Gaspésie et le sud du Labrador ont été libérés des glaces plus tôt que l’Ungava, soit entre 14 000 et 10 000 ans avant aujourd’hui (Richard, 1987). Ces territoires ont été colonisés par la toundra au début, puis par les sapinières vers 9 000 ans avant l’actuel.
C’est vers 4 000 ans avant aujourd’hui que l’érable à sucre, l’orme d’Amérique (Ulmus americana L.) et le frêne noir (Fraxinus nigra Marsh.) se sont installés dans les vallées encaissées du nord de la Gaspésie, mais sans réussir à coloniser les plateaux qui demeurent occupés par les conifères (Labelle et Richard, 1984).
Au sud, les glaces ont libéré les Appalaches (près de la frontière des ÉtatsUnis) entre 12 500 et 11 500 ans avant l’actuel (Parent et al., 1985). La mer de Champlain occupait les basses terres du Saint-Laurent et vers 10 800 ans avant nous, les glaces des basses Laurentides entraient en contact avec elle dans les grandes vallées. À cette époque, «des terres libres de glace se trouvaient coincées entre l’inlandsis et la mer, au nord des villes de Québec et de Montréal» (Richard, 1987).
Ainsi, la colonisation végétale s’est développée entre 12 500 et 7 500 ans avant l’actuel en Laurentie, d’abord dans les piémonts des Appalaches, puis des Laurentides et, finalement, dans les basses terres du Saint-Laurent, de façon centripète (Richard, 1987).
Le couvert végétal du Québec est relativement stable depuis 5 000 ans (Richard, 1987), mais vers 7 500 ans avant nos jours, surtout dans le sud, les groupements végétaux étaient très variés. Par exemple, les Laurentides étaient occupées par des pessières et des sapinières, sauf en altitude et dans les basses terres du Saint-Laurent. La sapinière à bouleau jaune et les érablières couvraient les terres récemment libérées par le retrait des eaux lacustres (Richard, 1987).
Aujourd’hui, ces mêmes basses terres sont occupées par les domaines de l’érablière à tilleul et de l’érablière à caryer, ces espèces étant plus thermophiles (préfèrent vivre à des températures plus élevées) que les espèces du domaine de l’érablière à bouleau jaune, situé dans les piémonts des Laurentides et des Appalaches (Richard, 1987).
1.2 Description Morphologique De L’arbre
Colette Ansseau et Hélène Bernier
L’érable à sucre présente des morphologies relativement différentes selon le lieu dans lequel il évolue. En milieu forestier, son fût est droit et il constitue les deux tiers ou plus de sa hauteur. La cime étroite, au sommet arrondi, est formée de branches grêles et ascendantes (Ministère des Terres et Forêts (MTF), 1979). Par contre, en terrain découvert, l’érable à sucre développe un fût plus court qui se divise plus près du sol en quelques grosses branches dressées. La cime plus large et plus fournie se rétrécit peu à peu en un sommet arrondi (Hosie, 1980).
Ce représentant du genre Acer est un des plus grands érables du Canada. Il peut atteindre une hauteur moyenne de 25 à 28 mètres (Marie-Victorin, 1977; MTF, 1979; Hosie, 1980) et on rapporte même une hauteur maximale de 40 mètres (MER, 1980). Le diamètre moyen se situe entre 60 et 90 cm et peut atteindre jusqu’à 150 cm au maximum (MER, 1980). Son enracinement est étalé et peut être assez profond, selon le type de sol (Harlow et al., 1978).
Les jeunes tiges ont une écorce grise et lisse. Elle devient gris foncé, crevassée, en longues bandes verticales profondes et irrégulières, verruqueuse et parfois un peu écailleuse chez les sujets plus vieux (Harlow et al., 1978; MTF, 1979; Hosie, 1980; MER, 1980; Little, 1984; Lauriault, 1987).
Le rameau glabre (sans poils), brun rougeâtre, grêle et luisant porte un bourgeon terminal pointu de 0,6 à 1 cm de long, comportant quatre à huit paires d’écailles brunes légèrement pubescentes. Les bourgeons latéraux sont semblables mais plus petits. Les cicatrices foliaires ont un patron en V. Les cicatrices vasculaires sont au nombre de trois (Harlow et al., 1978; MTF, 1979; Hosie, 1980; MER, 1980; Little, 1984).
Les feuilles d’A. saccharum sont opposées, simples, et palminerves, comprenant cinq nervures principales prenant leur origine à la base de la feuille. La feuille compte de trois à cinq lobes à sinus arrondis et très ouverts. Les sommets des lobes sont aigus, les bords sont entiers ou portent quelques dents irrégulières. Les dimensions rapportées pour la feuille varient; elles sont de 7 à 12 cm de long ou de large pour Harlow et al. (1978), Hosie (1980) et MER. (1980), de 8 à 15 cm de long pour Lauriault (1987) et de 9 à 14 cm de long et de large pour Little (1984). Le pétiole est long et souvent pubescent (Little, 1984). Le dessus des feuilles est d’un vert foncé tandis que le dessous est vert pâle et les deux surfaces sont glabres.
L’apex est acuminé, c’est-à-dire que le bout de la feuille se termine en pointe allongée et effilée (Marie-Victorin, 1977; Harlow et al., 1978; MTF, 1979; Hosie, 1980; MER, 1980; Lauriault, 1987). À l’automne, ces feuilles se colorent magnifiquement de jaune, de rouge, d’orange vif ou d’écarlate, ce qui donne aux érablières leur splendeur flamboyante si particulière dans l’est de l’Amérique du Nord.
À des fins de comparaison, on a réuni, dans le tableau 1.1, les principales caractéristiques morphologiques des quelques espèces d’Acer.
Tableau 1.1 Principales caractéristiques morphologiques des Acer
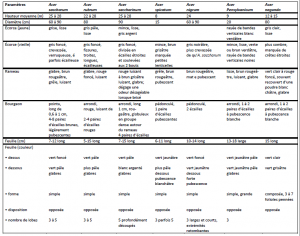

Références: Marie-Victorin, 1977, p.394 à 398; Harlow et al, 1978, p.401-402-405-406-408-409-411-412-415; M.T.F., 1979, p.69-71-73 et 101 à 103; Hosie, 1980, p.264-266-268-272-274-276-278-284; M.E.R., 1980, p.31 et 33; Little, 1984, p.572 à 575, 577 à 581; Lauriault, 1987, p.204-205, 220-221-224-225-230-231 et 233 à 238.
Des études morphologiques permettent d’analyser le développement des arbres selon la diversité des conditions d’éclairement. Roloff (1989) a ainsi montré que l’érable à sucre pouvait «survivre pendant plusieurs décennies dans l’ombre épaisse d’un peuplement grâce à la formation de chaînes de pousses courtes, acquérant alors une forme de croissance [ … 1 dans laquelle toutes les feuilles finissent par être disposées en un seul plan.» Cette disposition permet de maximiser la réception de la radiation lumineuse, limitante en sous-bois. Par contre, « la croissance libre se manifeste régulièrement chez des arbres juvéniles poussant à découvert jusqu’à l’âge d’environ 50 ans» (Roloff, 1989).
1.3 Appareil reproducteur
Colette Ansseau et Hélène Bernier
1.3.1 Fleurs: type et morphologie
Malgré les nombreuses recherches et les travaux de laboratoire effectués sur l’érable à sucre, bien des aspects de sa reproduction demeurent encore mal connus. C’est une des raisons pour lesquelles les mentions concernant les types de fleurs diffèrent parfois d’un auteur à l’autre.
Il semble que cette espèce soit andromonoïque (Hall, 1951 in Collins, 1989), c’est-à-dire qu’elle possède des fleurs mâles et des fleurs hermaphrodites ou parfaites (les fleurs hermaphrodites sont des fleurs bisexuées, donc qui portent à la fois les organes des deux sexes: étamines et pistil). Elle est toutefois considérée, par la majorité des auteurs consultés, comme polygame, ce qui signifie qu’on retrouve sur le même plant des fleurs hermaphrodites et des fleurs unisexuées (Fowells, 1965; De Jong, 1976; Harlow et al., 1978; MER, 1980).
Quelques auteurs parlent aussi de pseudohermaphrodisme (Hall, 1951 in Collins, 1989; Wright, 1953; Gabriel, 1968 et De Jong, 1976) considérant que, dans les fleurs hermaphrodites, il n’y a qu’un seul sexe fonctionnel à cause de l’existence d’un pistil avorté ou d’anthères qui ne parviennent pas à maturité.
Pour sa part, Little (1984), ne fait référence qu’à des fleurs mâles et des fleurs femelles sans aucune autre précision.
La morphologie de la fleur d’érable à sucre se définit ainsi:
fleur régulière, petite (environ 5 mm de long) et en forme de cloche (Hosie, 1980; Little, 1984); cinq sépales soudés; absence de pétales; disque nectarifère réduit; huit étamines insérées dans la marge intérieure du disque (Gabriel, 1968); filets allongés et pendants; ovaire dicarpellé et souvent tricarpellé (De Jong, 1976 in Collins, 1989); style court terminé par de longs stigmates.
Les inflorescences sont des corymbes latéraux sessiles, jaunâtres, avec des pédoncules capillaires et velus (Marie-Victorin, 1977; Harlow et al., 1978).
1.3.2 Mode de reproduction
La floraison des érables à sucre se produit tôt au printemps, après l’apparition des premières plantes de sous-bois (Trillium, Erythronium et Claytonia), en général dans la deuxième semaine de mai dans les Appalaches québécoises selon Collins (1989). L’anthèse, qui est le développement des organes floraux, se réalise avant le développement des feuilles selon De Jong (1976). Mais d’après Harlow et al. (1978), Hosie (1980), MER (1980) et Little (1984), les fleurs d’Acer saccharum apparaissent en même temps que les feuilles. La floraison se poursuit pendant cinq à dix jours après l’éclosion (Collins, 1989) (tableau 1.2).
Tableau 1.2 Comparaison des fleurs de quelques Acer

Références: Fowells, 1965,p.56-59-64-67-68; Marie-Victorin, 1977, p.394-398; Harlow et al., 1978, p.401-402-406- 408-412; M.T.F., 1979, p.69-71-73 et 101 à 103; Hosie, 1980, p.264-266-268-272-274-276-278-284; M.E.R 1980, p.31 et 33; Little, 1984, p.572 à 574 et 577 à 581; Lauriault, 1987, p.234 et 236.
Sur les rameaux, les inflorescences se développent à partir de bourgeons mixtes lorsqu’ils sont terminaux et à partir de bourgeons uniquement floraux lorsqu’ils sont latéraux (résultats de Sargent, 1891 cités dans De Jong, 1976 in Collins, 1989). Le mûrissement des fleurs se fait par étapes; celles de l’axe principal d’abord et ensuite celles des autres niveaux, ce qui crée un étalement de la dispersion pollinique (Hall, 1967 in Collins, 1989).
Il appert que la quantité de fleurs que produit l’érable à sucre varie d’année en année (Wright, 1953 in Collins, 1989). D’autre part, le rapport entre la quantité de fleurs mâles et celle de fleurs femelles est au moins de 10 pour 1, voire même probablement autour de 50 pour 1 (Fowells, 1965; Wright, 1953 in Collins, 1989).
La pollinisation
La plupart des auteurs s’entendent pour dire que l’érable à sucre a développé des adaptations à l’anémochorie ou est en voie de le faire. L’anémochorie est la pollinisation par le vent, par opposition à l’entomochorie qui est la pollinisation par les insectes (Hall, 1967; De Jong, 1976 et Hesse, 1979 in Collins, 1989). Cette interprétation est liée notamment à l’absence de pétales, à la réduction du disque nectarifère et au fait que les filets des étamines sont très longs et les fleurs pendantes (Hall, 1967 in Collins, 1989).
Cependant, Gabriel et Garrett (1984), qui ont testé la pollinisation en isolant des fleurs à l’aide d’un filet très fin laissant passer les grains de pollen mais non les insectes, n’ont trouvé aucune différence significative entre les fruits produits par les fleurs laissées à l’air libre et les autres. Wright (1953 in Collins, 1989) et Gabriel (1968) ont tendance à croire que l’érable à sucre est plutôt entomophile.
Un phénomène fort intéressant, la dichogamie, s’appliquerait de façon importante dans le mode de pollinisation de l’érable à sucre. Il s’agit d’une «méthode» de développement des fleurs selon laquelle les organes sexuels d’une même fleur parfaite (hermaphrodite ou bisexuée) n’arrivent pas à maturité en même temps de manière, suppose-t-on, à éviter l’autopollinisation. Dans le cas où les organes mâles atteignent la maturité avant les organes femelles sur la même fleur, celle-ci est appelée protandre tandis que les protogynes ont un pistil réceptif avant que les anthères soient mûres (Gabriel, 1968).
Selon Hall (1967 in Collins, 1989), les arbres fonctionnant ainsi sont, dans un premier temps, unisexués mâles et, par la suite, unisexués femelles, ou l’inverse. Ce décalage dans la maturation des fleurs permet une pollinisation croisée entre les arbres protogyniques et protandriques. Cette dichogamie ne serait pas complète pour Acer saccharum et l’autopollinisation naturelle reste probable pour la plupart des arbres d’après Wright (1953) et Gabriel (1961), ce dernier ayant obtenu des fruits par autofécondation (in Collins, 1989).
Les ancêtres du genre Acer étaient entomophiles et monoïques. Acer saccharum est considéré comme une espèce assez évoluée, s’étant adaptée à des conditions d’anémochorie comme Acer negundo, le plus évolué des érables, qui est complètement anémophile et dioïque (fleurs mâles et fleurs femelles sur des plants différents) (Collins, 1989). D’ailleurs, Wright (1953 in Collins,1989) estime qu’A. saccharum tendrait à devenir dioïque. On trouve en effet plusieurs arbres qui produisent des fleurs mâles en grande quantité avec encore quelques fleurs femelles, mais la plupart ne produisent que des fleurs mâles, par exemple dans la région de Philadelphie (Fowells, 1965).
Reproduction végétative
A. saccharum est une espèce qui produit de nombreux rejets de souche, notamment sur les sujets plus petits. En effet, une grande quantité de sujets vigoureux émergent à partir de bourgeons dormants. Il en résulte, d’après divers auteurs (Gilson, 1913; Levitt, 1956; White et Leaf, 1956), que ce sont les souches plus petites qui en produisent un plus grand nombre et les rejets sont plus vigoureux que ceux des souches plus grosses.
En outre, dans les peuplements plus âgés, le pourcentage de rejets de souche est inversement proportionnel à l’augmentation de la taille des arbres, à la densité du peuplement et au nombre d’années écoulées depuis une coupe. Le nombre de rejets par souche est aussi plus grand pour les arbres fraîchement coupés, diminuant peu à peu avec les années suivant la coupe (Merriam, 1898 in Fowells, 1965).
Brisson et al. (1988), dans une étude de successions secondaires sur sites mésiques dans dix stations forestières du haut Saint-Laurent, remarquent que «l’érable à sucre envahit les coupes davantage par graines que par voie végétative malgré une capacité reconnue de produire des rejets».
A. saccharum peut aussi, dans une certaine mesure, se reproduire par drageons (Fowells, 1965). Par contre la reproduction par bouturage semble difficile à obtenir car la réponse racinaire varie entre clones durant une même année et à l’intérieur de chaque clone sur différentes années (Braun, 1950 in Fowells, 1965).
1.3.3 Fruits: forme et dissémination dans l’espace
Après la floraison printanière, les fleurs mâles tombent au sol avec leur pédicelle tandis que les fleurs femelles non fécondées vont former un fruit sans graine (parthénocarpie) (Collins, 1989). En l’absence de pollinisation, c’est de 50 à 100 % des fleurs femelles qui développent des fruits parthénocarpiques, de même taille que les fruits normaux (De Jong, 1976 in Collins, 1989).
Pour les cas où la fécondation s’est avérée un succès, les fruits commencent à se développer souvent en présence des stigmates et des étamines (Collins, 1989).
L’érable à sucre forme, à partir de son ovaire bicarpellé, un fruit composé de deux samares (disamare) ailées, réunies à la base, contenant chacune une graine, bien qu’il soit fréquent de n’en trouver qu’une par fruit (Carl et Yawney, 1972). Les disamares sont vertes pendant l’été, deviennent vert-jaunâtre lorsqu’elles sont mûres et passent rapidement au brun en tombant à la fin de leur longue période de mûrissement (plus longue que celle des autres Acer) qui a lieu à l’automne, fin septembre début octobre (De Jong, 1976 in Collins, 1989).
Le fruit a une forme en U, aux extrémités légèrement divergentes. Il possède un long pédicelle qui le dépasse souvent en longueur, une graine épaisse et sa longueur est de l’ordre de 2 à 3 cm (Harlow et al., 1978; Hosie, 1980; MER, 1980; Little, 1984) (tableau 1.3).
Tableau 1.3 Comparaison des fruits des différentes espèces d’Acer
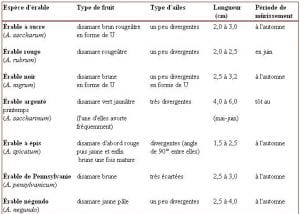
Références: Fowells, 1965, p.56-59-64; Marie-Victorin, 1977, p.394 à 398; Harlow et al., 1978, p.401-402-404-406- 408-409-412; M.T.F., 1979, p.69-71-73 et 101 à 103; Hosie, 1980, p.264-266-268-272-274-276-278-284; M.E.R., 1980, p.31 et 33; Little, 1984, p.573 à 575 et 578 à 581; Lauriault, 1987, p.205-221-224-230-234-236-238.
Ce type de fruit ressemblant à la fois à une hélice et à un parachute, se détache de l’arbre et tombe en tournant lentement autour d’un axe imaginaire (Marie-Victorin, 1977). Ainsi, selon l’angle de chute et de légères asymétries de la structure, le fruit se retrouve plus ou moins loin de l’arbre, souvent en dehors de la zone d’ombre, ce qui facilite sa germination. Les samares sont disséminées par le vent (Collins, 1989).
1.3.4 Production de graines, dormance et dissémination dans le temps
Les graines
L’érable à sucre produirait une bonne quantité de graines à des intervalles de deux à cinq ans (Brown, 1938; White et Leaf, 1956). Ce cycle de production est dû à la génétique de l’espèce ou aux conditions climatiques.
Par ailleurs, Wright (1953 in Collins, 1989) a observé peu de mortalité des fleurs et des fruits. Ainsi, la quantité de fleurs produite dans une année permet de déterminer le nombre de fruits qui en résultera.
La graine d’érable à sucre est composée d’un embryon et de téguments (enveloppes externes du fruit). L’embryon comporte une radicelle, un hypocotyle, un épicotyle et deux longs cotylédons verts enroulés (Carl et Yawney, 1972). Il est protégé par un tégument externe, le testa de 75 m d’épaisseur et par une seconde enveloppe, le péricarpe, qui se différencie en exocarpe et endocarpe, respectivement de 265 m et 82 m d’épaisseur (Webb et Dumbroff, 1969).
La dormance des graines
À partir de l’automne, l’embryon est morphologiquement complet, mais il entre dans une période appelée dormance, définie par Webb et Dumbroff (1969) comme une incapacité de l’embryon à germer à cause d’un blocage métabolique interne. Ces auteurs ont découvert que la dormance d’Acer saccharum est due en partie à la présence des téguments. En effet, lorsque ceux-ci sont extraits du fruit et de la graine, la période de dormance est nettement réduite. Elle passe de 61 à 43 jours sans péricarpe et à 23 jours seulement sans testa (Webb et Dumbroff, 1969). Par contre, l’activité microbienne y est alors beaucoup plus intense que pour des graines protégées par ces mêmes enveloppes (Webb et Dumbroff, 1969). Il est donc clair que ces téguments jouent un rôle important dans la dormance des graines de l’érable à sucre.
La dormance est aussi associée à une période de surmaturation nécessaire à la germination future. D’après Webb et al. (1973), des transformations de certains composés chimiques de la graine se produisent pendant cette période et certains d’entre eux retarderaient la germination (Enu-Kwesi et Dumbroff, 1980).
À l’automne, la graine mûre contient beaucoup de graisses et de protéines mais peu d’hydrates de carbone; c’est pourquoi elle doit subir une période de surmaturation pendant l’hiver (Marie-Victorin, 1977).
La germination
La germination des graines de l’érable à sucre se produit tôt au printemps, dès la fonte des neiges (Collins, 1989). La levée de la dormance et la germination exigent une température optimale de 5 °C (Collins, 1989). Il est à noter que la perte de graines causée par les prédateurs, notamment les écureuils et les oiseaux, représente un faible pourcentage et est, somme toute, considérée comme négligeable (Fowells, 1965; Collins, 1989).
Comme chez les autres érables, les graines d’A. saccharum atteignent un taux élevé de germination, pouvant aller jusqu’à 95 % les bonnes années. Cela représente environ 20 millions de fruits par hectare dans un peuplement d’arbres mûrs (Harlow et al., 1978).
Les jeunes pousses tolèrent bien l’ombre et peuvent vivre longtemps sous le couvert forestier du peuplement et, comme l’arbre lui-même peut atteindre de 300 à 400 ans (Harlow et al., 1978), il est logique que les érablières apparaissent comme des peuplements stables.
1.4 Morphométrie De L’érable À Sucre
Denis Ouellet
1.4.1 Généralités
L’érable à sucre peut atteindre des dimensions importantes. Selon Marie-Victorin (1977), des arbres de 40 mètres de hauteur ont été signalés. Cependant, la réalité canadienne les situe plus près de 25 à 27 in (Hosie, 1990). Au Québec, les peuplements mûrs ont une hauteur moyenne de 22 m avec un dhp (diamètre à hauteur de poitrine) de 40 à 45 cm.
Les études portant sur la morphométrie de l’érable à sucre sont plutôt limitées. Au Québec, des travaux d’estimation de la biomasse aérienne ont été réalisés à partir d’un échantillonnage effectué dans les unités de gestion 34, 51, 62, 72 et 77, soit un gradient est-ouest qui tient compte de la distribution de l’érable au Québec (Ouellet, 1983). Il est à noter que l’érable à sucre et l’érable rouge ont été jumelés pour cette étude. Ces travaux, bien que comportant certains aspects de morphométrie, se limitaient à la détermination de la biomasse en subdivisant la partie aérienne en grandes composantes.
Les connaissances sur la morphométrie des espèces présentent un intérêt particulier à plusieurs égards. Dans le passé, les travaux de recherche en foresterie étaient de nature empirique; on intervenait dans le milieu pour constater ensuite la réaction des diverses composantes de l’écosystème. Toutefois, de plus en plus de travaux, visant une connaissance rationnelle du fonctionnement des composantes de l’écosystème, nécessitent ces informations de base. À titre d’exemple, la recherche sylvicole s’oriente vers une meilleure compréhension de l’effet des modifications des facteurs du milieu sur le développement de l’arbre, en particulier sur la compétition entre les individus. Ces modifications induisent des changements architecturaux qui, à leur tour, modifient l’appareil photosynthétique, donc la surface foliaire, ce qui aura des effets sur l’allocation de carbone, la croissance de l’arbre et éventuellement sur ses qualités technologiques.
Dans un autre ordre d’idées, les outils de télédétection aéroportés et satellitaires permettent, à partir des relations entre la projection des cimes – ou l’indice foliaire – et les variables dendrométriques, d’effectuer certaines évaluations quantitatives de la ressource forestière.
Les résultats présentés dans cette section sont issus d’une étude réalisée à la station forestière de Duchesnay, à environ 40 km au nord-ouest de la ville de Québec. L’altitude varie entre 150 et 480 m, avec une moyenne de 300 m. La période moyenne sans gel y est de 114 jours, et la température moyenne annuelle de 3,6 °C (Programme climatologique canadien, 1982). Le nombre de degrés-jours moyens au-dessus de 0 °C est de 2 615. Les peuplements forestiers de la station sont composés à 80 % d’érables à sucre, de bouleaux jaunes et de hêtres à grandes feuilles.
Trente-quatre érables à sucre, provenant de cinq placettes échantillons, ont été sélectionnés parmi l’étage dominant de leur peuplement respectif. Les arbreséchantillons ont été sélectionnés sur la base du dhp, dans le but de couvrir l’ensemble des classes de diamètre. Ces arbres étaient exempts de défauts visibles. Une évaluation du dépérissement, effectuée selon les normes en vigueur pour le «North American Sugar Maple Decline» (Miller et al., 1991), donne généralement un indice de dépérissement de 5 (1 à 5 %) et un indice de transparence du feuillage de 20 (15 à 25 %), ce qui les classe dans les arbres considérés sains.
1.4.2 Les relations allomètriques
Les principales grandeurs morphométriques ont été mesurées, soit le diamètre à 1,3 m (dhp), la hauteur totale (ht), la largeur et la longueur de la cime et la surface de projection de la cime. Les valeurs moyennes et les écarts-types, ventilés par classe de dhp de 5 cm, sont présentées au tableau 1.4.
Tableau 1.4 Description des principales grandeurs morphométriques de l’érable à sucre par classe de 5 cm au dhp
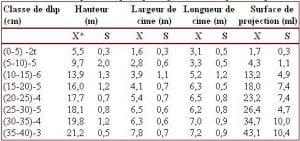
* X est la moyenne et S l’écart-type t nombre d’arbres-échantillons de la classe
La surface foliaire est estimée à partir d’un échantillonnage de 10 feuilles portées par les rameaux courts et 10 feuilles portées par les rameaux longs (si disponibles) dans chacun des tiers de la cime, pour un maximum de 60 feuilles par arbre. La surface et le poids frais de chaque feuille ont été mesurés le plus rapidement possible. Le poids anhydre a été mesuré à la suite d’un séchage à 100 °C pendant 24 heures.
Le tableau 1.5 présente les équations de prédiction des principales grandeurs morphométriques, soit la hauteur totale, la largeur de la cime, la longueur de la cime et sa surface de projection. Le modèle utilisé est polynomial du premier ou du second degré et la variable indépendante est le dhp. L’ajustement, exprimé par le coefficient de détermination R2, donne de bons résultats sauf pour la longueur de la cime qui présente une plus grande variabilité.
Tableau 1.5 Relations allométriques de l’érable à sucre: coefficients des équations pour le modèle général Y= a + b dhp + c dhp2
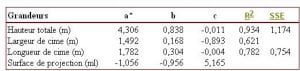
a, b et C sont les coefficients des équations du modèle. L’absence des coefficients a, b et c signifie que la variable indépendante, le dhp ou (dhp2), est non significative et exclue du modèle.
1.4.3 Estimation de la biomasse aérienne et de la surface foliaire
Plusieurs études sur l’estimation de la biomasse ont été publiées au Canada, surtout au début des années 1980 (Alemdag, 1981 et 1984; Ker, 1980 et 1984; Lavigne et Van Nostrand, 1981; Lavigne, 1982; Ouellet, 1983 et 1985). Cependant, la plupart de ces études étaient concentrées sur la détermination de la biomasse utilisable à des fins de production d’énergie. L’estimation de la masse foliaire et sa surface n’étaient généralement pas prises en compte.
Les composantes de la partie aérienne considérées pour l’étude sont: la masse totale, la partie marchande de la tige (jusqu’à 9 cm dans les branches), la cime (incluant les branches < 9 cm et le feuillage), les rameaux (branches < 3 cm excluant le feuillage) et les feuilles. Le modèle utilisé a été linéarisé par transformation logarithmique et la correction de Baskerville (1972) a été appliquée afin de corriger le biais introduit lors du retour à l'échelle arithmétique. Les coefficients de masse verte sont présentés au tableau 1.6 et ceux de masse anhydre au tableau 1.7. Les variables indépendantes utilisées dans le modèle sont le dhp et la hauteur totale. Si l'une ou l'autre de ces variables est non significative, elle est exclue du modèle. L'ajustement du modèle donne d'excellents résultats, dû au fait que les arbres échantillons proviennent tous de l'étage dominant de leur peuplement respectif.
Tableau 1.6 Estimation de la masse verte des composantes : coefficients des équations pour le modèle général Y = a dhpb htc
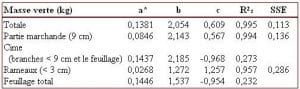
a, b et c sont les coefficients des équations du modèle. L’absence du coefficient c signifie que ht est non significatif. Le modèle est alors tronqué de cette variable indépendante et de son exposant.
t R2 et SSE sont exprimés dans l’échelle logarithmique.
Tableau 1.7 Estimation de la masse anhydre des composantes: coefficients des équations pour le modèle général Y = a dhpb htc
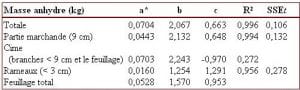
a, b et c sont les coefficients des équations du modèle. L’absence du coefficient c signifie que ht est non significatif. Le modèle est alors tronqué de cette variable indépendante et de son exposant.
t R2 et SSE sont exprimés dans l’échelle logarithmique.
La masse verte des rameaux du premier, deuxième et troisième tiers représente respectivement 13, 43 et 44 % de la masse des rameaux de l’arbre. Pour le feuillage, les valeurs sont de 8, 34 et 58 % de la masse de feuillage pour le premier, deuxième et troisième tiers, le premier tiers étant le tiers inférieur de l’arbre.
La surface foliaire est estimée à partir de la masse verte de feuillage. Pour les besoins du présent travail, toutes les feuilles ont été combinées, sans distinction du type de rameau porteur ni du tiers dans la cime. L’équation (1) permet l’estimation de la surface foliaire à partir de la masse verte de feuillage.
Surface foliaire (m2) = 6,768 masse verte (kg) (1)
où le coefficient de détermination (R2) est de 0,94 et l’erreur-type de l’estimée est de 0,002. Il est donc possible, à partir du dhp, d’estimer la masse verte de feuillage et, de l’équation (1), sa surface foliaire. Ainsi, pour un arbre de 10 cm au dhp et une masse verte estimée de 5,0 kg (équation de la masse verte de feuillage, tableau 1.6), sa surface foliaire estimée sera de 33,8 m2. De même, pour un dhp de 30 cm et une masse verte estimée de 26,9 kg, la surface foliaire sera de 182 m2.
1.5 Système Radiculaire
Bady Badibanga
1.5.1 Généralités
Au Québec, le milieu pédologique forestier dans lequel se développe l’érable à sucre varie énormément, notamment en fonction de la nature de la roche-mère (calcaire ou acide) et du microrelief. Dans le cas précis des érablières sucrières, les chablis ont fréquemment façonné, dans ces écosystèmes forestiers, un microrelief particulier, caractérisé par la présence de bosses et de creux. Ce microrelief fait que les sols biens drainés des bosses côtoient, sur de courtes distances, les sols souvent imparfaitement à mal drainés des creux. Il en résulte également d’importantes variations dans les épaisseurs et les types d’horizons du sol (Pagé et al., 1991).
La première zone de contact entre l’érable à sucre et le milieu pédologique étant constituée par le système radiculaire, la morphologie de celui-ci sera influencée par les conditions qui prévalent dans ce milieu pédologique. Aussi, la présence de l’érable à sucre sur des sols aussi différents que les brunisols, les podzols et parfois les gleysols engendre-t-elle, dans chacun de ces types de sol, une configuration particulière du système radiculaire des individus qui s’y développent. De même, la proximité de sols bien et mal drainés oblige parfois l’érable qui se développe dans ce milieu à explorer, en même temps, deux types de sol différents (podzol et gleysol par exemple).
De plus, quel que soit le type de sol ou le microrelief, une racine d’arbre explore généralement plusieurs horizons de sol (F, A, B, C)1, soumettant par le fait même ses différentes parties à différentes conditions physiques, chimiques et biologiques.
1.5.2 Morphologie radiculaire de l’érable à sucre
Les caractéristiques du système radiculaire de l’érable à sucre dépendent en partie de sa génétique et en partie des conditions qui prévalent dans son environnement pédologique. À l’instar d’autres espèces arborescentes – et des angiospermes en particulier – la morphologie du système radiculaire de l’érable à sucre est caractérisée sur la base d’éléments tels que: 1- la longueur des racines primaires, secondaires, tertiaires, etc.; 2- leur taille; 3- l’amplitude de la ramification; 4- les angles de ramification (Harper et al., 1991; Grime et al., 1991; Rundel et Nobel, 1991; Curl et Truelove, 1986).
Racines primaires
Le jeune érable à sucre émet généralement une racine principale, laquelle se ramifie, en cours de croissance, en de nombreuses racines (secondaires, tertiaires, etc.) et radicelles, ce qui donne à l’ensemble du système radiculaire un aspect buissonnant. Cependant, compte tenu du microrelief en bosses et creux caractéristique des érablières sucrières du Québec, la morphologie du système radiculaire de l’érable à sucre sera influencée par ce microrelief et les types de sols qu’il engendre (Badibanga et al., 1992).
La figure 1.5 donne une représentation schématique des sols et du système radiculaire, caractéristiques des divers sites sur lesquels peuvent croître les érables à sucre. Quel que soit le site, les érables à sucre se développent surtout sur les bosses. Cependant, sur roche-mère acide (sites caractérisés par des sols de type podzols sur les bosses et de type gleysols dans les creux), les érables à sucre émettent, à partir des bosses, des racines principales qui s’enfoncent jusque dans les horizons B, puis s’éloignent de la base du tronc et ce, plus ou moins parallèlement à la surface du sol. Le diamètre de ces racines, imposant à la base de l’arbre, diminue rapidement pour atteindre 2 ou 1 cm, taille qui est généralement conservée sur presque toute la longueur. Les racines principales peuvent ainsi avoir une longueur de 5 à 6 m. Au niveau des creux, les racines principales traversent l’horizon Aeg ou la partie supérieure de l’horizon Bg (figure 1.5 A).
Figure 1.5 Représentation schématique du microrelief et des sols sur roche-mère acide (A) et sur roche-mère calcaire (B) Source: Badibanga et al. (1992)
Sur roche-mère calcaire (sites caractérisés par des sols de type brunisols tant sur les bosses que dans les creux), les érables à sucre émettent, à partir des bosses également, des racines principales de taille importante près de l’arbre. Elles s’enfoncent jusqu’à la base de l’horizon Ah pour s’éloigner ensuite de l’arbre en demeurant à ce niveau dans le sol jusqu’au creux voisin. Contrairement aux racines principales des érables à sucre se développant sur roche-mère acide, la longueur des racines principales des érables à sucre sur roche-mère calcaire dépasse rarement 4 m. Dans les creux, les racines principales pénètrent l’horizon Ah et traversent celui-ci en évitant souvent de pénétrer dans l’horizon Bmgj sousjacent (figure 1.5 B).
Racines secondaires, tertaires et radicelles
Sur roche-mère acide, les racines principales se ramifient, sur les bosses, en racines secondaires et tertiaires. Celles-ci émettent des radicelles, non seulement dans les horizons B et BC, mais également vers les horizons supérieurs F et Ah. Dans ces deux derniers horizons, les radicelles se développent en longueur et de façon très enchevêtrée (figure 1. 6). Dans l’horizon B, les radicelles se développent souvent en touffes; elles sont généralement courtes et individualisées. On observe fréquemment un réseau dense de radicelles au contact de l’horizon BC avec l’horizon Cxgj, horizon fragique dont la dureté empêche la pénétration des racines.
Figure 1.6 Représentation schématique des radicelles dans les horizons de sol des sites sur roche-mère acide et sur roche-mère calcaire Source: Badibanga et al. (1992)
Dans les creux, les racines secondaires et tertiaires sont émises surtout vers les horizons supérieurs F et Ah, où elles se ramifient en un réseau dense de radicelles (figure 1.5 A). Les racines principales et secondaires peuvent traverser les creux pour pénétrer dans l’horizon B podzolique de la bosse adjacente et y émettre à nouveau des radicelles. Il est à noter que, dans les creux, le mauvais drainage des sols limite la pénétration en profondeur des racines. Le développement du système radiculaire s’effectue donc surtout dans les horizons de surface qui bénéficient d’une meilleure aération.
Sur roche-mère calcaire, les racines principales émettent un grand nombre de racines secondaires et tertaires, lesquelles se ramifient par touffes en un réseau dense de radicelles dans les horizons Ah et Bm (figure 1.5 B). Dans l’horizon Ah, les radicelles ne représentent pas un modèle de distribution enchevêtré comme c’est le cas des radicelles dans les horizons Ah des sols sur roche-mère acide, mais elles sont plutôt courtes (< 1 cm) et individualisées (figure 1.6). Dans les creux, la présence d'horizons Bmgj, caractéristiques d'un milieu humide et peu aéré, ne permet pas un bon développement du système radiculaire.
1.5.3 Conclusion
Les érables à sucre se développent dans des milieux pédologiques variés caractérisés généralement par un microrelief en bosses et creux. La morphologie de leur système radiculaire sera donc fonction, du moins en partie, de la nature des sols et du microrelief. De façon générale, les érables à sucre se développent sur les bosses et émettent, à partir de celles-ci, des racines principales qui pénètrent soit dans les horizons B soit dans les horizons Ah pour s’éloigner de la base du tronc et ce, plus ou moins parallèlement à la surface du sol jusqu’au creux voisin. Les racines principales émettent, sur les bosses, des racines secondaires et tertaires qui se ramifient en radicelles longues et enchevêtrées ou courtes et individualisées. Dans les creux, le mauvais drainage empêche souvent un bon développement du système radiculaire qui tend à demeurer dans les horizons de surface mieux aérés. L’érable à sucre a donc un système radiculaire relativement superficiel qui le rend très sensible au chablis.
Bibliographie
Alemdag, I. S., 1981. Équations de masse pour la portion épigée de six essences de feuillus dans des peuplements naturels de la forêt expérimentale de Petawawa. Inst. For. Nat. Petawawa, Serv. Can. For., Environ. Can., Rap. Inf. PI-X-6 F, 10 p.
Alemdag, I. S., 1984. Total tree and merchantable stem biomass equations for Ontario hardwoods. Petawawa Nat. For. Inst., Can. For. Serv., Environ. Can., Inf Rep. PI-X-46, 46 p.
Ansseau, C. et M. M. Grandtner, 1988. Énumération des groupements végétaux de trois secteurs forestiers des Cantons de l’Est, Québec. 2- Groupements forestiers. Documents phytosociologiques, N.S. Vol. M, Camerino, Italie, 55 p.
Badibanga, B., F. Pagé, A. Sauvesty et C. Ansseau, 1992. Le système radiculaire dans les érablières du Québec. II. Le développement radiculaire en relation avec le microrelief et la roche-mère. Can. J. For. Res. 22: 1568-1574.
Baskerville, G., 1972. Use of logarithmic regression in the estimation of plant biomass. Can. J. For. Res. 2: 41-53.
Brisson, J., Y. Bergeron et A. Bouchard, 1988. Les successions secondaires sur les sites mésiques dans le Haut- St-Laurent, Québec, Canada. Can. J. Bot. 66 (6): 1192-1203.
Cart C. M. Jr. et H. W. Yawney, 1972. Multiple seedlings in Acer saccharum. Bull. Torrey Bot. Club 99(3): 142-144.
Collins, L., 1989. La reproduction sexuée d’Acer saccharum Marsh. Travail présenté au Dr. Paul Comtois dans le cadre du cours GÉO 6263 Pollen et pollinisation, Univ. de Montréal, Québec, Canada, 34 p.
Cronquist, A., 1981. An integrated system. of classification of flowering plants. Columbia University Press, New York, USA, 1262 p.
Curl, E. A. et B. Truelove, 1986. The rhizosphere. Springer Verlag, Berling, 288 p.
Dansereau, P., 1943. L’érablière laurentienne. I. Valeur d’indice des espèces. Can. J. Res. Sect. C, 21: 66-93.
Dansereau, P., 1946. L’érablière laurentienne. II. Les successions et leurs indicateurs. Can. J. Res. Sect. C, 24: 235- 291.
Deysson, G., 1979. Organisation et classification des plantes vasculaires. Deuxième partie. Systématique. Cours de botanique générale, quatrième série, tome II. Sedes, Paris, France, 540 p.
Enu-Kwesi, L. et E. B. Dumbroff, 1980. Changes in phenolic inhibitors in seeds of Acer saccharum during stratification. J. Exp. Bot. 31: 425-436.
Fowells, H. A., 1965. Silvics of forest trees of the United States. Agric. Handbook n° 271, Dept. Agric., US For. Serv., 762 p.
Gabriel, W. J., 1968. Dichogamy in Acer saccharum; Bot. Gaz. 129(4): 334-338.
Gabriel, W.J. et P.W. Garrett, 1984. Pollen vectors in Sugar maple, Acer saccharum; Can. J. Bot. 62(12): 2889- 2890.
Grandtner, M. M., 1966. La végétation forestière du Québec méridional. Les Presses de l’Univ. Laval, Québec, Québec, Canada, 216 p.
Grime, J. P., B. D. Campbell, J. M. L. Mackey et J. C. Crick, 1991. Root plasticity, nitrogen capture and competitive ability. Dans: Atkinson, D. (éd.). Plant root growth: an ecological perspective. Blackwell Scientific Publications, Oxford, 381-397.
Guignard, J.-L., 1986. Abrégé de botanique; sixième édition. Masson, Paris, France, 259 p.
Harlow, W. M., E. S. Harrar et F. M. White, 1978. Textbook of dendrology, covering the important forest trees of the United States and Canada; 6th edition. McGraw-Hill series in forest ressources, USA, 510 p.
Harper, J. L., M. Jones et N. PL Sackville Hamilton, 1991. The evolution of roots and the problem of analysing their behaviour. Dans: Atkinson, D. (éd.). Plant root growth: an ecological perspective. Blackwell Scientific Publications, Oxford, 3-22.
Holmes, S., 1983. Outline of plant classification. Longman Group Limited, New York, USA, 181 p.
Hosie, R. C., 1980. Arbres indigènes du Canada, huitième édition; Approv. et Services Canada, Presses Élites inc., Montréal, Québec, Canada, 389 p.
Ker, M. F., 1980. Tree biomass equations for seven species in southwestern New-Brunswick. Maritimes For. Res. Centre, Can. For. Serv., Environ. Can., Inf. Rep. M-X- 114, 18 p.
Ker, M. F., 1984. Biomass equations for seven major maritimes tree species. Maritimes For. Res. Centre, Can. For. Serv., Environ. Can., Inf. Rep. M-X-148, 54 p.
Labelle, C. et P.J. H. Richard, 1984. Histoire postglaciaire de la végétation dans la région de Mont-Saint-Pierre, Gaspésie. Géographie physique et Quaternaire 38(3): 257-274.
Landry, B. et M. Mercier, 1984. Notions de géologie; deuxième édition. Modulo Éditeur, Outremont, Canada, 437 p.
Lauriault, J., 1987. Guide d’identification des arbres du Canada. Marcel-Broquet, La Prairie, Québec, Canada, 551 p.
Lavigne, M. B., 1982. Tree mass equations for common species of Newfoundland. Newfoundland For. Res. Centre, Can. For. Serv., Environ. Can., Inf. Rep. N-X-213, 40 p.
Lavigne, M. B. et R. S. Van Nostrand, 1981. Biomass equations for six tree species in Central Newfoundland. Newfoundland For. Res. Centre, Can. For. Serv., Environ. Can., Inf. Rep. N-X-199, 51 p.
Levitt, J., 1956. The hardiness of plants. Academic Press, 278 p. Little, E. L., 1984. The Audubon Society Field Guide tc, North American Trees. Eastern region, Knopf, New York, USA, 714 p.
Mabberley, D. J., 1987. The plant book. A portable dictionary of the higher plants. Cambridge University Press, New York, USA, 706 p.
Marie-Victorin, Frère, 1977. Flore laurentienne; deuxième édition, 6′ tirage. Les Presses de l’Univ. de Montréal, Montréal, Québec, Canada, 927 p.
Miller, L, D. Lachance, W.G. Burkman et D. C. Allen, 1991. North American Sugar Maple: organization and field methods. US Dept. Agric., For. Serv., Northeastern For. Exp. Stat., Radnor (PA), Gen. Tech. Rep. NE-154 .
Ministère de l’Énergie et des Ressources, 1980. Les principaux arbres du Québec. Gouv. du Québec, MER, Dir. Comm., ERI-3740-9, 72 p.
Ministère des Terres et Forêts, 1979. Petite flore forestière du Québec, 4e tirage. Éditions France-Amérique, Québec, Canada, 216 p.
Ouellet, D., 1983. Biomass prediction equations for twelve commercial species in Quebec. Laurentian For. Res. Centre, Can. For. Serv., Environ. Can., Inf. Rep. LAU-X-62E, 34 p.
Ouellet, D., 1985. Biomass equations for six commercial tree species in Quebec. For. Chron., 61(3): 218-222.
Pagé, F., G. Roy, G. Gagnon et M. Giroux, 1991. Le chaulage des sols des érablières du Québec. Agrosol 4 (1): 59-61.
Parent, S., 1990. Dictionnaire des sciences de l’environnement. Broquet, Ottawa, Canada, 748 p.
Parent, M., J.-M. Dubois, P. Bail, A. Larocque et G. Larocque, 1985. Paléogéographie du Québec méridional entre 12 500 et 8000 ans BP; Recherches amérindiennes au Québec, 15(1-2): 17-37.
Programme climatologique canadien, 1982. Normales climatiques au Canada 1951-1980. Serv. environ. atmos., Environ. Can., Downsview, Ontario, Canada, Vol. 1-6.
Radford, A. E., 1986. Fundamentals of plant systematics. Harper and Row, New York, USA, 498 p.
Richard, P.J. H., 1987. Le couvert végétal au Québec-Labrador et son histoire postglaciaire. Notes et documents. Univ. de Montréal, dépt. géographie, N° 87-01, Montréal, Canada, 74 p.
Rundel, P. W. et P. S. Nobet 1991. Structure and function in desert root systems. Dans: Atkinson, D. (ed.). Plant root growth: an ecological perspective. Blackwell Scientific Publications, Oxford, 103-130.
Roloff, A., 1989. Kronenentwicklung und Vitalitätsbeurteilung ausgewählter Baumarten der gemässigten Breiten. (Le développement de la cime et l’évolution de la vitalité de certaines essences forestières des zones tempérées). Schriften aus der Forstlichen Fakultät der Universität Göttingen und der Niedersächsischen Forstlichen Versuchsanstalt. Sauerländer’s Verlag Frankfurt am Main. Band 93. 189 p.
Takhtajan, A., 1986. Floristic regions of the world. Univ. of California, California, USA, 522 p.
Thibault, M., 1985. Les régions écologiques du Québec méridional (carte). MER, Québec, Québec.
Webb, D. P. et E. B. Dumbroff, 1969. Factors influencing the stratification process in seeds of Acer saccharum. Can. J. Bot. 47(10): 1555-1563.
Webb, D. P., J. Van Staden et P. F. Wareing, 1973. Seed dormancy in Acer. J. Exp. Bot. 24(78): 105-116.
2 Physiologie de l’érable à sucre
2.1 Physiologie De La Croissance
Annick Bertrand
Le cycle vital de l’érable à sucre (Acer saccharum Marsh.) est semblable à celui de la plupart des arbres décidus d’Amérique du Nord. On assiste d’abord au débourrement des bourgeons au printemps. Au cours de l’été, il y a croissance des feuilles, des rameaux et du système racinaire ainsi que croissance radiale du tronc. La formation des samares s’effectue durant l’été et elles arrivent en général à maturité au début de septembre. La lignification des rameaux survient à la fin de l’été et est suivie de la sénescence et de l’abscission des feuilles. À l’automne, tous les organes de l’arbre s’endurcissent au froid et les bourgeons entrent en dormance pour l’hiver. Une caractéristique du cycle vital de l’érable à sucre lui donne son caractère unique: la coulée de la sève printanière qui a lieu aux mois de mars et d’avril et qui revêt une grande importance économique (section 2.2.2).
Il est difficile de généraliser sur les paramètres de croissance de l’érable à sucre puisqu’ils varient d’une année à l’autre et qu’en plus du bagage génétique de chaque individu, plusieurs facteurs peuvent affecter sa croissance. L’érable champion de la province de Québec se trouve à Stanbridge-Est, en Montérégie. La circonférence de cet arbre de 250 ans est de six mètres et sa hauteur est de 30 m. Pendant ses bonnes années, lors de la coulée de la sève, son propriétaire y pratiquait 18 entailles pour la récolte de l’eau (Baucher, 1994).
L’érable à sucre est rarement retrouvé en peuplement homogène mais plutôt en compétition avec de nombreuses autres espèces. L’érable est une espèce tolérante à l’ombre et les jeunes semis peuvent survivre sous un couvert forestier où le rayonnement solaire constitue souvent le facteur limitatif. Bicknell (1982) a comparé la croissance de l’érable à sucre à celle d’autres espèces afin de mieux connaître les effets des arbustes à croissance rapide sur la régénération de cette espèce économiquement importante. Les résultats de ses travaux démontrent que la croissance annuelle de l’érable à sucre commence tôt et se fait de façon rapide. Ainsi, les bourgeons sont formés dès le début d’août. Cependant, sur une période de six ans, l’érable a un taux de croissance plus lent que celui de Prunus pensylvanica, une espèce intolérante à l’ombre dont la vie est courte et qui est l’espèce la plus dominante parmi les huit étudiées.
D’autre part, l’érable est une espèce à croissance déterminée, c’est-à-dire que les primordia de feuilles qui seront disponibles pour la prochaine saison de croissance sont produits pendant la saison actuelle (Gregory, 1980). Selon Bicknell (1982), les patrons de croissance d’espèces vivant en communauté sont une adaptation pour une utilisation efficace de l’environnement et pour éviter la suppression d’une espèce à l’autre. Il semble y avoir une relation entre la durée de croissance des rameaux, la tolérance à l’ombre et le type de croissance, soit déterminé ou indéterminé. Le patron saisonnier de développement du couvert forestier débute par la mise en place des feuilles des espèces déterminées et rantes, comme l’érable, qui se retrouvent en position sous-dominante. La mise en place de toutes les feuilles très tôt au printemps est un avantage compétitif pour l’érable à sucre. Ainsi, l’érable est assuré d’une courte période d’exposition en plein soleil avant l’arrivée des feuilles des autres espèces. De plus, l’établissement hâtif du feuillage permet à chaque feuille d’être productive pour une plus longue période de temps. Les espèces tolérantes sont ensuite progressivement ombragées par les espèces intolérantes dont la croissance se continue plus tard dans l’été et dont la position devient dominante dans le couvert végétal. Ce mécanisme est mis en place pour que les espèces tolérantes à croissance lente puissent survivre sous un couvert dense d’espèces à croissance rapide.
Bellefleur et Larocque (1983) ont comparé la croissance de l’érable à sucre entre des conditions de plein rayonnement solaire (coupe rase) et des conditions d’ombrage, sous couvert forestier. Après deux années de croissance, la moyenne d’accroissement annuel en diamètre des semis d’érable à sucre est de 3,0 mm en coupe rase et de 1,0 mm sous couvert forestier. Leur accroissement annuel moyen en hauteur est de 225,2 mm en coupe rase et de 67,7 mm sous couvert forestier. Ces chercheurs concluent des résultats de leurs travaux qu’une faible intensité de rayonnement solaire constitue un des facteurs les plus limitatifs de la croissance de l’érable à sucre.
2.2 Caractéristiques physiologiques de l’érable à sucre
Annick Bertrand
2.2.1 Fixation du carbone et allocation des sucres
L’irradiance solaire est un facteur environnemental majeur qui limite la photosynthèse et la croissance des espèces vivant sous un couvert forestier. Ellsworth et Reich (1992) ont mesuré les taux de photosynthèse de jeunes arbres (cinq à sept ans) sous différentes intensités lumineuses (à découvert après une coupe rase ou sous couvert forestier). La densité du flux de photons photosynthétiques (PPFD) diurne moyenne est de 932 mol m-2 s-1 à découvert et de 9,4 mol m-2 s-1 sous couvert forestier. À découvert, le taux maximal de photosynthèse mesuré est de 3 mol CO2 m-2 s-1 à midi et on observe ensuite une diminution du taux de photosynthèse entre 12h00 et 15h00. Sous couvert forestier, le taux de photosynthèse à 10h00 est beaucoup plus bas que sous ensoleillement (1 mol CO2 m-2 s-1 ) et il augmente légèrement au cours de la photopériode pour atteindre 1,5 mol CO2 m-2 s-1 à 15h00. Ellswort et Reich (1992) expliquent que la baisse de photosynthèse habituellement observée en après-midi en plein soleil est principalement due à l’augmentation de température de la feuille et à l’augmentation de la différence de pression de vapeur (DPV) entre la feuille et l’air qui en résulte. L’augmentation de la DPV fait diminuer le potentiel hydrique de la feuille et cause la fermeture des stomates.
Ces facteurs sont en relation différente selon que l’érable se retrouve à découvert ou sous couvert forestier. Chez les arbres à découvert, la DPV augmente de 0,8 à 1,8 KPa entre 10h00 et 12hOO et le potentiel hydrique et la conductance stomatique diminuent de -1,3 à -2,5 et de 80 à 50 mol m-2s-1 respectivement au cours de la même période de temps. Sous couvert forestier, la température des feuilles demeure stable, ce qui explique en partie l’absence de baisse de photosynthèse. Dans ces conditions, le potentiel hydrique à 10h00 est de -0,5 MPa et il diminue très peu, la valeur la plus négative atteinte à 12h00 étant de -1,5 KPa. En conséquence, la conductance se maintient pendant le jour à une valeur moyenne de 75 mol m-2 s-1 et ce, malgré une augmentation de la DPV de 1,2 à 1,8 KPa. Il semble que les échanges gazeux des érables sous couvert forestier soient peu dépendants de la différence de pression de vapeur entre la feuille et l’air. D’après Chazdon (1988), le fait que les stomates soient relativement insensibles à une augmentation de la DPV est un mécanisme d’adaptation pour les espèces vivant sous un couvert forestier, car ils peuvent ainsi avoir un taux maximal d’assimilation du CO2 durant les épisodes éphémères de soleil accompagnés d’une DPV élevée. Pour la même espèce se retrouvant à découvert, la sensibilité accrue des stomates à la DPV empêche les pertes d’eau excessives et la dessication des tissus.
Dans une étude comparant le taux de photosynthèse de quatre espèces d’arbres sur un site cinq ans après une coupe rase, Amthor et al. (1990) ont constaté que le taux de photosynthèse de l’érable est le plus bas parmi les espèces étudiées. De plus, le taux de photosynthèse de l’érable est saturé à un PPFD > 1000 mol m-2 s-1 alors qu’il continue d’augmenter, pour deux des autres espèces, jusqu’à 2 000 mol m-2 s-1. Ces deux caractéristiques font de l’érable un piètre compétiteur dans un écosystème récemment perturbé alors que la tolérance à l’ombre lui permet d’être une espèce dominante avant une coupe. Un des avantages compétitifs de l’érable lors de la phase d’établissement d’un lement est le développement hâtif des feuilles au printemps qui lui permet une période d’assimilation du carbone sans restriction d’intensité lumineuse.
D’après Kozlowski et Ward (1957), 90 % de la croissance d’un érable se fait pendant les 75 jours suivant le débourrement des bourgeons au printemps. Le développement des feuilles et la croissance en hauteur de l’érable qui ont lieu au début du printemps se font aux dépens des photosynthats de l’année précédente. Les auteurs observent aussi que les arbres cessent de croître pendant l’été alors que la photosynthèse est encore efficace. il semble qu’à partir du moment où la croissance cesse, les sucres s’accumulent jusqu’à ce qu’une réserve maximale soit atteinte à l’automne et qu’elle puisse servir ultérieurement à la reprise printanière de la prochaine année. L’accumulation de certains types d’hydrates de carbone peut aussi être en cause dans l’acclimatation au froid des arbres et dans la coulée de la sève au printemps.
Les changements de concentration des hydrates de carbone dans les racines de l’érable à sucre ont été étudiés au cours d’une année (Wargo, 1971). Les résultats démontrent que le niveau d’amidon commence à augmenter après le débourrement des bourgeons et atteint un maximum vers le mois de février, mois à partir duquel les concentrations diminuent vers un minimum atteint au mois de mai. Cependant, entre le mois d’octobre et le mois de décembre, on observe une diminution de la concentration d’amidon concomitant à une augmentation du maltose dans les racines. Cette conversion indique que l’hydrolyse de l’amidon est due à l’action de l’amylase (Sauter et Van Cleve, 1991). L’abscission des feuilles pourrait être le facteur déclencheur du catabolisme de l’amidon. Il semble que le réservoir de maltose formé à partir du catabolisme de l’amidon soit continuellement converti en sucrose. La concentration de sucrose diminue graduellement pendant l’été jusqu’à une baisse rapide au mois d’octobre. Les concentrations de sucrose et de ses galactosides, le raffinose et le stachyose, augmentent ensuite d’octobre à décembre, pendant l’endurcissement au froid, puis diminuent progressivement jusqu’au mois de mai. Des concentrations élevées de sucrose ont été retrouvées pendant l’acclimatation au froid de tissus ligneux (Sakai, 1966). L’étude de Wargo (1971) sur les sucres confirme que les températures proches du point de congélation accélèrent la formation du sucrose et de ses galactosides (stachyose et raffinose) en favorisant la conversion d’amidon en sucres plus simples. Chez l’érable à sucre, les concentrations de stachyose et de raffinose commencent à augmenter vers la fin de l’été pour atteindre un maximum au milieu de l’hiver lorsque les arbres sont les plus endurcis au froid et diminuent ensuite jusqu’à disparaître après le débourrement des bourgeons. L’accumulation de ces deux sucres est corrélée à l’endurcissement au froid de la luzerne (Castonguay et al., 1994) et du peuplier (Sauter et Van Cleve, 1991). Les rôles du sucrose, du stachyose et du raffinose lors de l’endurcissement des plantes au froid peuvent être de stabiliser les membranes lors de la déshydratation cellulaire induite par le gel ou de protéger les enzymesclé du métabolisme végétal (Crowe et al., 1990).
2.2.1.1 Métabolisme de réserves et de défense
Annie Sauvesty
D’une façon générale, lorsqu’une plante fixe par photosynthèse le dioxide de carbone, celui-ci est immédiatement assimilé. Il est alors utilisé pour la synthèse de l’amidon (métabolite de réserve) ou, s’il quitte le chloroplaste, pour la respiration ou pour la synthèse du saccharose ou d’autres composés carbonés (métabolites de défense par exemple). Son allocation implique donc un nombre important de voies biochimiques et d’étapes de compartimentation.
Il est essentiel pour la croissance de l’arbre et pour sa survie qu’un équilibre soit établi entre l’utilisation immédiate et l’accumulation du carbone. C’est pourquoi, le devenir des substances carbonées est régi par des processus de régulation, lesquels déterminent les voies de synthèse à privilégier.
Un stress environnemental peut, par exemple, provoquer des changements dans les processus physiques, biochimiques, physiologiques ou même morphologiques d’une plante. C’est ainsi que le métabolisme de la feuille varie en fonction de sa position dans la cime de l’arbre. Cette variation se traduit par des teneurs en saccharose (métabolite de réserve) et en composés phénoliques (métabolites indicateurs de stress) plus élevées dans le haut de la cime que dans le bas (Figure 2.1). En effet, les feuilles les plus hautes sont celles les plus exposées au rayonnement solaire et aux agressions atmosphériques (vent, pluie, polluants etc … ), de même qu’elles sont tributaires de la montée des éléments nutritifs jusqu’à elles.
Figure 2.1 Teneurs en sucres et en composés phénoliques (C.P.) foliaires en relation avec la hauteur de la feuille dans la cime et les conditions d’humidité du milieu pédologique. Deux moyennes suivies de la même lettre ne sont pas significativement différentes à P<= 0,05
Par ailleurs au Québec, un grand nombre d’érables à sucre vivent dans des conditions de stress, peu favorables à leur développement. Tel est le cas, entre autres, des arbres qui se développent en milieux pédologiques faiblement aérés (Sauvesty et al., 1993). Cette situation se manifeste fréquemment par des changements importants dans le métabolisme général de l’arbre. C’est ainsi que dans les feuilles, les teneurs en sucres réducteurs sont faibles, reflétant une photosynthèse moins active que dans les milieux mieux aérés (Figure 2.1). À l’inverse, les réserves carbonées (amidon et saccharose) y augmentent de façon importante, et cela dès le début de la saison végétative. C’est également dans les milieux les moins aérés que les teneurs en composés phénoliques foliaires sont les plus élevées.
L’augmentation des métabolites de réserve et de défense dans les feuilles d’érables se développant en milieu stressant, est le résultat d’un processus d’adaptation qui se traduit dans la feuille par des changements dans l’allocation du carbone nouvellement formé. Au lieu d’être destinée à la croissance, une partie du pool de carbone est allouée d’une part au métabolisme de défense et d’autre part, au métabolisme de réserve. Les réserves sont appelées “réserves tampon”, et leur rôle est alors à la fois de restaurer et maintenir l’homéostasie, et également de fournir les substrats carbonés nécessaires à la photosynthèse et à la synthèse des composés phénoliques.
Ainsi, pour un grand nombre d’érablières se développant en milieux pédologiques peu aérés, les arbres subissent des stress importants, ce qui se traduit chez certains d’entre eux moins résistants, par un dépérissement.
2.2.2 Coulée de la sève
Annick Bertrand
La conversion des sucres est un phénomène important dans le mécanisme de la coulée printanière de la sève. En effet, la présence du sucrose dans le xylème est nécessaire pour qu’il y ait coulée printanière (Johnson et al., 1987). L’amidon accumulé pendant l’été est transformé en sucrose au début de l’hiver alors que les enzymes en cause dans cette conversion sont activées par les basses températures. Le contenu en sucre de l’eau d’érable varie de 0,5 à 7,0 % mais est habituellement de 2,0 à 3,0 %. En plus du sucrose et d’une petite quantité de glucose, l’eau d’érable contient des sels inorganiques, des peptides, des acides aminés, de l’amylase et certains régulateurs de croissance dont la présence semble physiologiquement importante (Bertrand et al., 1994). La saveur caractéristique d’érable se développe lors du processus d’évaporation sous l’effet de la chaleur et est attribuée à certains acides aminés. La pyrazine fait aussi partie des composés constituant cette saveur (Alli et al., 1990).
Le mécanisme de la coulée de la sève n’est pas encore totalement élucidé mais une meilleure connaissance du phénomène peut aider à optimiser la production d’eau et favoriser l’industrie de l’érable qui est la troisième production agricole au Québec (Bureau de la Statistique du Québec). La coulée printanière est étroitement liée à la température de l’air. Des conditions de gel la nuit suivies de températures plus élevées pendant le jour sont indispensables au phénomène. La coulée de la sève peut avoir lieu indépendamment des racines et peut être reconstituée à partir de sections de tiges ou de branches si la succession des températures au-dessous et au-dessus de 0 °C est respectée. Ceci démontre que la coulée est due à la pression dans la tige et que la sève récoltée pendant le jour provient des tiges de l’érable. La coulée se déroule en deux étapes: une phase d’absorption qui a lieu pendant les nuits froides et une phase d’exsudation qui se déroule lors du réchauffement des températures. D’après Tyree (1984), la sève est attirée vers le sommet des arbres alors que les branches, plus exposées au froid, gèlent au cours de la nuit. L’appel d’eau vers le sommet de l’arbre est dû à la baisse du potentiel hydrique causée par la perte d’énergie libre de l’eau lors de son passage sous forme solide. Des cristaux de glace sont ainsi formés dans les parties des branches et de la tige exposées au froid. Lorsque la température passe au-dessus du point de congélation, la sève congelée redevient liquide et redescend par gravité vers le bas de l’arbre et les entailles.
Le phénomène est dû aux propriétés particulières du bois de l’érable dont les cellules fibreuses sont remplies de gaz plutôt que d’eau comme chez la plupart des autres espèces ligneuses. La présence de gaz dans les fibres de bois attire l’eau par des forces capillaires et laisse de l’espace pour l’expansion de l’eau lors de la formation de glace. Lors de la fonte de la glace, les bulles d’air comprimé servent aussi à chasser la sève par pression et accélèrent le phénomène de la coulée. Cette explication principalement physique de la coulée ne tient pas compte de certains phénomènes biologiques comme, par exemple, l’exigence de la présence de sucrose dans la sève pour la coulée (Johnson et al., 1987). Cette théorie explique toutefois pourquoi les arbres ayant le meilleur rendement en eau d’érable sont ceux dont les rayons vasculaires sont les plus larges (Morselli et al., 1978). Il y a ainsi plus d’espace pour la montée de la sève lors de la phase d’absorption. Renaud et Allard (communication personnelle) ont calculé, en tenant compte de la quantité de sève récoltée (50 litres par arbre), de la teneur en sucre de la sève (2 %) et d’une approximation réaliste des réserves du tronc en amidon (22 kg), qu’environ 4,5 % des réserves carbonées de l’érable étaient prélevées au cours d’une saison de récolte de la sève. Le prélèvement des réserves par l’entaillage est donc peu élevé et c’est pourquoi il n’affecte pas la croissance des arbres.
2.2.3 Régulateurs de croissance
Au cours des années 70, on a tenté de mesurer la concentration des régulateurs de croissance, en particulier celle de l’acide abscissique (inhibiteur de croissance) et celle des citokinines (stimulateurs de croissance), dans plusieurs organes de l’érable à sucre et de les associer aux événements physiologiques majeurs du cycle vital de l’arbre. La séquence des événements où les régulateurs de croissance ont potentiellement un rôle à jouer peut être résumée ainsi (Taylor et Dumbroff, 1975): au début de l’automne, les bourgeons de l’érable sont en dormance et ne répondent pas à une élévation de la température ou à l’allongement des jours jusqu’au mois de février; durant cette période, le contenu en eau des bourgeons diminue jusqu’à un niveau constant et l’activité des racines diminue progressivement, en même temps que baisse la température du sol; entre la mi-janvier et la mi-février, on observe un déplacement marqué du potentiel de débourrement des bourgeons axillaires vers le bourgeon terminal.
Taylor et Dumbroff (1975) ont constaté que vers la fin de février, il y a augmentation de l’activité des citokinines et du contenu en eau des bourgeons en même temps que les bourgeons terminaux deviennent physiologiquement actifs et que la croissance racinaire reprend. Ces chercheurs concluent que les niveaux élevés de citokinines endogènes servent à contrer l’effet des inhibiteurs dans les tissus dormant. Dans une étude subséquente, Dumbroff et al., (1979) ont mesuré la concentration d’acide abscissique (ABA) des bourgeons de l’érable à sucre et ont constaté que la concentration d’ABA atteint un maximum vers la fin de novembre, alors que les bourgeons sont en dormance profonde et qu’elle diminue lors de la transition des bourgeons de l’état de dormance à celui de quiescence. Ils concluent que l’ABA est essentiel à la dormance sans être responsable de l’initiation du phénomène puisque la concentration d’ABA commence à augmenter un mois après l’entrée en dormance des bourgeons.
Des études récentes avec des plantes herbacées ont démontré que l’ABA contenu dans l’exsudat du xylème était responsable de la communication entre les racines et la tige lorsqu’un stress, comme la sécheresse, survient d’abord au niveau du sol et nécessite une réponse de la partie aérienne (Zhang et al., 1990). Chez l’érable à sucre, il a été démontré que l’incidence du dépérissement augmentait sensiblement en réponse à un gel au niveau du sol pendant l’hiver (Bertrand et al., 1994). De plus, en réponse au gel du sol hivernal, ces chercheurs ont mesuré une augmentation de la concentration d’ABA dans l’exsudat du xylème de l’érable le printemps suivant. Cette concentration était plus élevée chez les arbres montrant le plus de symptômes de dépérissement. Chez l’érable à sucre, il est probable que l’ABA du xylème soit impliqué dans la communication entre les racines et la tige en réponse au stress et que cet inhibiteur de croissance soit en partie responsable des symptômes du dépérissement tels que le flétrissement des feuilles, la diminution de la surface foliaire ou la mort en cime. De plus, la concentration d’ABA mesurée dans l’eau d’érable au printemps est un indicateur précoce du stress hivernal subi par les arbres.
2.2.4 Nutrition minérale
Rock Ouimet
2.2.4.1 Absorption minérale
Les plantes absorbent les éléments minéraux du sol principalement par les radicelles en contact avec la solution du sol. Ces éléments nutritifs parviennent aux radicelles sous forme d’ions dissous. Avec le dioxyde de carbone et l’eau, ils sont utilisés par l’arbre pour fabriquer la matière végétale. Les principaux éléments minéraux du sol nécessaires aux arbres sont présentés au tableau 2.1.
Tableau 2.1 Principaux éléments minéraux et forme ionique la plus commune utilisée dans l’absorption et le métabolisme des arbres
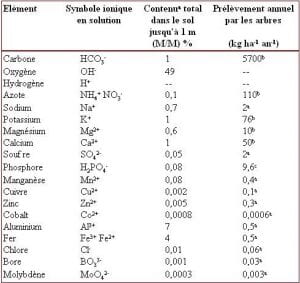
a D’après les données de Vinogradov dans Bohn et al. (1985)
b D’après Cole et Rapp (1981)
c D’après Yanai (1992).
Les ions voyagent dans le sol et sont absorbés par les radicelles selon deux mécanismes d’absorption: l’un est le prélèvement des ions dissous dans la solution du sol absorbée par les plantes afin d’ajuster leur statut hydrique (transport passif ou mass flow); l’autre est le prélèvement préférentiel de certains ions à un taux différent de celui occasionné par le transport passif. Ce dernier mécanisme entraîne un gradient de concentration dans le sol causant le déplacement des ions par diffusion pour contrer ce gradient. Ce mécanisme d’absorption est appelé transport actif. Les ions Ca2+, Mg2+, SO42- et NO3– , très mobiles dans le sol, sont principalement absorbés par transport passif, tandis que les ions K+, NH4+, H2PO4–, BO33-, MoO42-, Cu2+, Fe3+ et Mn2+ sont surtout absorbés par transport actif, car ces ions sont en faible concentration dans la solution du sol et ils sont spontanément adsorbés sur ses colloïdes.
L’absorption des éléments minéraux du sol est grandement influencée par le type de couvert forestier ainsi que par les propriétés physico-chimiques du sol. Le stade de développement de la forêt influence également le prélèvement annuel en éléments nutritifs. Celui-ci s’accroît durant les premières années du développement du peuplement, jusqu’à la fermeture du couvert. Une fois ce stade atteint, le taux de prélèvement annuel des éléments nutritifs demeure relativement constant.
Les conditions climatiques peuvent aussi modifier le prélèvement annuel. L’étude de simulation de Foster et al. (1992) illustre bien l’impact de déficits hydriques enregistrés en 1982-1983 et en 1988-1989 sur le prélèvement et la dynamique des éléments nutritifs dans les érablières. Les faibles réserves en eau utile du sol coïncideraient durant ces périodes avec de faibles concentrations en NO3– de la solution du sol et une diminution de l’accroissement radial des érables. Lorsque les réserves en eau du sol tendent à s’épuiser, le potentiel de rétention de l’eau par le sol augmente. L’absorption par les racines devient alors plus difficile et l’arbre réagit en fermant les stomates de ses feuilles. La fermeture des stomates a pour effet de réduire la transpiration des arbres, mais entraîne une réduction de la photosynthèse et de l’accumulation de la biomasse.
2.2.4.2 Composition minérale foliaire
La composition minérale foliaire révèle des informations importantes sur le statut nutritif du peuplement forestier, car généralement plus des deux tiers des éléments nutritifs prélevés se retrouvent ou passent par les feuilles, siège de la synthèse de la matière organique.
L’analyse foliaire a été la méthode privilégiée au cours de la période de diagnose des déséquilibres nutritionnels dans le cadre de la recherche et du programme de lutte contre le dépérissement des érablières durant les années 80-90. En effet, la plupart des travaux de recherche se sont basés principalement sur des analyses minérales pour définir une relation entre le déclin forestier actuel et le statut nutritif de l’écosystème (Sauvesty et al., 1993). Des carences en certains éléments minéraux ont été décelées, soit dans les feuilles (Bernier et Brazeau, 1988a, 1988b; Paré et Bernier, 1989; Hendershot, 1989), soit dans le sol (Beaton, 1978; Gagnon et al., 1985; Mahendrappa et al., 1986; Tamm, 1974; Toutain et al., 1987; Weetman et Hill, 1978; Wright et al., 1988). Au Québec, Bernier et Brazeau (1988a, 1988b) dénoncent de faibles teneurs en potassium (K) ou en magnésium (Mg) (selon la région) dans les feuilles d’érables atteints par le dépérissement. Gagnon et al., (1986) observent une diminution des cations échangeables de calcium (Ca), Mg et K dans l’humus des érablières du Québec, comparativement à il y a plusieurs années. Ces résultats ont permis de mettre en évidence que plus la carence minérale est importante, plus le dépérissement de l’arbre est marqué. Cependant, le peu de connaissances sur la nutrition de l’érable à sucre a causé de graves difficultés pour déterminer les seuils critiques et optimums pour cette espèce (tableau 2.2). Le statut nutritif foliaire des arbres peut être influencé par plusieurs facteurs (van Den Driessche, 1974).
Tableau 2.2 Seuils critiques et de santé pour l’érable à sucre (échantillonnage entre la mi-juillet et la mi-août)
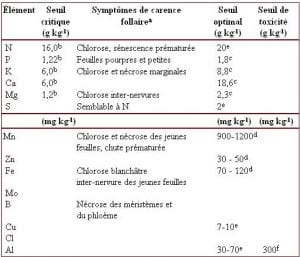
a D’après B. Bernier, Université Laval (notes de cours)
b Estimé d’après Camiré et Ouimet (1990)
c D’après Ouimet et Camiré (1991)
d Estimé tentatif d’après les données publiées par Bernier et Brazeau (1988a, b, c, d)
e Estimé tentatif d’après les données de Whittaker et ai. (1979)
f Estimé d’après les données de Thorton et ai. (Il 986).
Facteurs environnementaux
Plusieurs travaux récents ont porté sur la réaction du statut nutritif de l’érable à sucre à différents facteurs environnementaux. L’intensité lumineuse, les périodes de sécheresse, la température et l’altitude influencent le statut nutritif des forêts. Par exemple, une carence en bore (B), manifestée chez des érables en régénération, a été attribuée à la basse température qui a prévalu en juin 1987, ainsi qu’aux fortes précipitations survenues auparavant (Bernier et Brazeau, 1988d).
En plus des déséquilibres nutritifs observés dans les érablières en dépérissement, des stress d’origine «naturelle», en particulier des périodes de sécheresse, sont associés au phénomène du dépérissement (Bernier, Paré et Brazeau, 1989). Par ailleurs, alors qu’il y a eu une augmentation appréciable de la température durant les saisons de croissance (avril à octobre) depuis 1986, Pagé et al., (1993) ont observé, chez des érables d’une érablière expérimentale, une amélioration graduelle de la santé et de l’état nutritionnel des arbres au cours de ces années.
Le statut nutritif foliaire des érables varie également au cours de la saison de croissance (Lea et al., 1979a, 1979b). Les concentrations en azote (N), phosphore (P), K, sodium (Na) et cuivre (Cu) de la matière sèche des feuilles sont les plus élevées au début et diminuent jusqu’en fin de saison. Les concentrations en Ca, manganèse (Mn), fer (Fe) et aluminium (AI) ont un comportement opposé; elles augmentent du début de la saison de végétation jusqu’à la fin. Les concentrations foliaires en Mg, zinc (Zn) et cobalt (Co) sont, quant à elles, relativement constantes durant la saison de croissance.
Facteurs morpholoqiques et physiologiques
Morrison (1985) a établi que la position du feuillage dans la cime avait un effet sur la teneur en éléments nutritifs des feuilles. Les concentrations foliaires en K, Ca, Mg, Fe, Zn et Na étaient généralement plus élevées dans le bas du houppier, tandis que, pour les autres éléments analysés, aucune différence significative n’était attribuable à la position dans le houppier. Les variations d’un arbre à un autre étaient inférieures dans le milieu et le bas de la cime comparativement au haut du houppier. Aucune différence significative n’a été observée dans la composition élémentaire des feuilles situées à un même niveau aux quatre points cardinaux; ainsi, quelle que soit l’orientation de la feuille dans l’arbre, les teneurs en éléments nutritifs sont les mêmes.
Le dépérissement des érablières au Québec a aussi fait l’objet d’analyses foliaires. Des carences en K ont été mises en évidence dans les érablières dépérissantes de la région des Appalaches (Bernier et Brazeau, 1988a, 1988b; Ouimet et Fortin, 1992), tandis que dans les basses Laurentides, on a observé des carences en Mg (Bernier et Brazeau, 1988c).
Facteurs pédologiques
En général, les propriétés physico-chimiques du sol ont un impact majeur sur l’état nutritionnel des arbres. La concentration du Ca et du Mg dans le feuillage de l’érable à sucre est reliée très fortement à la disponibilité de ces éléments dans le sol (Ouimet, 1990; Mader et Thompson, 1969).
Les érablières en dépérissement des Appalaches présentent des carences en K. Ces carences sont associées principalement à une réduction de la saturation en Ca échangeable ainsi qu’à une disponibilité élevée du Mg dans les sols de cette région, causant un effet antagoniste K-Mg qui inhiberait le prélèvement du K par les érables (Ouimet et Camiré, 1993). Paré et Bernier (1989) ont observé une relation entre le statut foliaire en P de l’érable à sucre, le type d’humus et la disponibilité de cet élément dans l’humus mull en fonction de son acidité.
Les carences en Mg des érablières situées dans les basses Laurentides sont associées à des sols pauvres en bases disponibles. Les différences observées entre les Appalaches et les basses Laurentides s’expliquent a priori par les sols ayant des compositions minéralogiques différentes qui se reflètent sur la disponibilité du Mg. Dans les basses Laurentides, les sols sont issus principalement de till composé de granite et de syénite, pauvres en Ca et Mg (Raymond et al., 1976), tandis que les sols des Appalaches sont dérivés en grande partie de till composé de grès, d’ardoises, de shistes et de roches ultrabasiques (en particulier la région de Thetford Mines), riches en Mg (Ouellet et al., 1991; St-Julien et Hubert, 1975).
2.3 Facteurs limitant la croissance et le développement de l’érable à sucre
2.3.1 Eau
David Pothier
L’eau est la composante majeure des plantes ligneuses puisqu’elle constitue environ 50 % de leur poids frais. Une grande partie de cette eau est située dans les cellules vivantes et forme alors un milieu propice aux réactions biochimiques. Elle joue plusieurs rôles dans la physiologie des arbres grâce à ses propriétés physiques et chimiques particulières.
Les ponts hydrogène entre les molécules d’eau sont responsables de plusieurs propriétés qui ont une grande importance pour les plantes. Ainsi, les valeurs élevées de la chaleur spécifique et de la chaleur latente de vaporisation de l’eau protègent les plantes contre des changements rapides de température. De plus, la nature polaire des molécules d’eau fait en sorte qu’elles sont fortement attirées les unes aux autres, ce qui se traduit par une force de cohésion permettant la formation des colonnes d’eau nécessaires à son transport des racines jusqu’aux feuilles.
L’eau est aussi un solvant pour plusieurs substances et peut donc servir de véhicule aux acides aminés, aux hydrates de carbone de faible poids moléculaire, à plusieurs ions et à de petites molécules sous forme gazeuse comme l’oxygène. Cette propriété de l’eau, conjointement avec sa force de cohésion, permet donc le transport des éléments minéraux des racines jusqu’aux feuilles.
Mécanismes de transport
Le transport de l’eau dans un arbre se fait par diffusion, c’est-à-dire le mouvement d’une région à haut niveau d’énergie vers une région à faible niveau d’énergie. La mesure de l’énergie disponible pour le mouvement de l’eau est appelée potentiel hydrique (ψ). Le potentiel hydrique de l’eau pure est, par définition, égal à zéro. La présence d’une substance dissoute dans l’eau a pour effet d’abaisser son potentiel hydrique, qui atteint alors une valeur négative. De plus, lorsque l’eau est soumise à un état de tension (comme c’est généralement le cas de l’eau dans le xylème), le potentiel hydrique est négatif. Par conséquent, le mouvement de l’eau dans un arbre se fait d’un endroit où ψ a de faibles valeurs négatives (e.g. -0,1 MPa) vers un endroit où il a de fortes valeurs négatives (e.g. -2,0 MPa). L’expression «stress hydrique» est associée à des valeurs très basses de ψ.
La force permettant à l’eau de se déplacer du sol jusqu’au sommet d’un arbre est fournie par le gradient de ‘ψ entre le sol et l’atmosphère. Puisque l’eau se déplace d’un endroit à fort potentiel vers un endroit à faible potentiel, il faut donc que le potentiel hydrique de l’atmosphère soit plus bas que celui du sol. Cette condition est généralement remplie puisque dans des conditions normales d’humidité relative de l’atmosphère, l’air a un potentiel hydrique plus bas que celui du sol.
Le faible potentiel hydrique de l’atmosphère fait en sorte que l’eau des feuilles est attirée vers l’atmosphère et l’évaporation qui en résulte est appelée transpiration. Ce phénomène abaisse la teneur en eau des cellules foliaires, provoquant ainsi une diminution de leur potentiel hydrique. Cette baisse du ‘y des feuilles a pour effet d’établir un gradient de potentiel hydrique entre les feuilles et le xylème des branches, ce qui crée un mouvement d’eau des branches jusqu’aux feuilles. En peu de temps, le gradient de ψ s’établira partout dans l’arbre (des feuilles aux racines), permettant l’entrée de l’eau du sol dans les racines. Ainsi, le gradient de ψ qui s’établit entre le sol et l’atmosphère permet aux arbres de puiser l’eau dans le sol et de la diriger vers l’atmosphère par l’entremise de leurs feuilles.
De façon à pouvoir transpirer, les feuilles possèdent de petites ouvertures appelées stomates, généralement situées sur leur face inférieure. Les stomates sont dotés d’un mécanisme de fermeture qui peut être actionné en réaction à des stimuli internes ou externes. En présence de lumière, les arbres tentent de garder leurs stomates ouverts le plus longtemps possible de façon à avoir accès au CO2 atmosphérique nécessaire à la photosynthèse. Il faut donc considérer la transpiration comme étant un inconvénient au fonctionnement normal de l’appareil photosynthétique. Toutefois, certains avantages sont associés à l’inconvénient que représente la transpiration. Ainsi, le transport des éléments minéraux absorbés par les racines est facilité par le mouvement d’eau provoqué par la transpiration. De plus, l’évaporation d’eau à la surface des feuilles abaisse leur température, ce qui est particulièrement important pour les feuilles directement exposées au soleil lors des chaudes journées d’été.
Facteurs associés au stress hydrique
Tous les facteurs ayant une influence sur le taux de transpiration des arbres sont susceptibles de participer au développement d’un stress hydrique. Dans la présente section, ces facteurs seront abordés selon un ordre qui correspond au cheminement de l’eau dans les arbres, c’est-à-dire à partir du sol jusqu’à l’atmosphère.
L’absorption de l’eau par les racines peut être influencée par des facteurs édaphiques comme la température, l’aération et la disponibilité en eau du sol. Une baisse de la température du sol peut réduire l’absorption de l’eau en augmentant sa viscosité, mais aussi en ralentissant la croissance racinaire, ce qui diminue le volume de sol prospecté par les racines. De plus, le gel en profondeur du sol, conséquence d’une absence de couvert nival lors de périodes de froid intense, peut causer des bris aux racines et ainsi diminuer l’absorption d’eau par les arbres (Pomerleau, 1991). Cet auteur a d’ailleurs observé un dépérissement de la cime de bouleaux et d’érables soumis à des traitements de gel en profondeur du sol. L’aération du sol peut aussi affecter l’absorption d’eau par les racines; un manque d’oxygène peut diminuer la croissance racinaire et même provoquer leur mort. Ainsi, les arbres situés sur des sols inondés peuvent paradoxalement souffrir de stress hydrique parce qu’incapables d’absorber l’eau du sol. Par ailleurs, une baisse de la disponibilité en eau du sol a pour effet de diminuer le potentiel hydrique de celui-ci, ce qui signifie que l’arbre doit abaisser le potentiel hydrique de ses racines pour absorber l’eau. Une trop grande baisse de la teneur en eau du sol peut donc entraîner un stress hydrique important pour l’arbre qui sera alors obligé de fermer ses stomates pour diminuer ses pertes en eau.
Après avoir été absorbée par les racines, l’eau est dirigée dans le xylème des racines qui communique avec celui de la tige principale et des branches. Chez l’érable à sucre, les éléments conducteurs du xylème forment un réseau de vaisseaux de calibres relativement importants, ce qui assure un transport généralement efficace de l’eau dans la tige. Ce transport est important pour acheminer rapidement l’eau des racines jusqu’aux feuilles et ainsi compenser les pertes dues à la transpiration. Cependant, Yang et Tyree (1993) ont mis en évidence que les rameaux d’érable à sucre plus petits que 1 cm en diamètre exerçaient une résistance relativement importante au passage de l’eau. De plus, dans l’aubier, la résistance au passage de l’eau peut être amplifiée par la formation d’embolies dans les vaisseaux; ceux-ci sont alors inutilisables pour le transport de l’eau, ce qui peut provoquer un stress hydrique (Tyree et Dixon, 1986; Sperry et Tyree, 1988; Sperry et al., 1988).
Chez les feuilles, un stress hydrique se manifeste par la fermeture des stomates. De façon générale, les stomates d’une feuille d’érable s’ouvrent à la lumière du matin pour avoir accès au CO2 et débuter les activités photosynthétiques. Lorsque les stomates sont ouverts, le taux de transpiration des feuilles est dépendant des facteurs reliés à la demande évaporative de l’atmosphère comme la température, l’intensité lumineuse, l’humidité relative et le vent. La transpiration des feuilles entraîne une diminution de leur potentiel hydrique qui se répercute jusqu’aux racines où débute l’absorption d’eau. Toutefois, pendant le jour, la quantité d’eau évaporée à la surface des feuilles est généralement plus élevée que la quantité d’eau absorbée par les racines, ce qui crée un déficit hydrique. Lorsque ce déficit hydrique devient trop élevé, les stomates se ferment pour limiter les pertes en eau, réduisant du même coup l’absorption de CO2 . La rapidité avec laquelle ce déficit hydrique augmente est dépendante des facteurs favorisant un taux de transpiration élevé. Le développement d’un stress hydrique est donc accéléré par une augmentation de la température de l’air, de l’intensité lumineuse, de la vitesse du vent et par une baisse de l’humidité relative de l’air (Pereira et Kozlowski, 1977). De plus, ces auteurs mentionnent qe le déficit hydrique des érables à sucre peut être accéléré par un faible ratio entre la superficie racinaire et la superficie foliaire.
Effets des trop grands déficits hydriques
Une baisse du potentiel hydrique des feuilles d’érable à sucre est normale et nécessaire à l’absorption d’eau par les racines. C’est lorsque ce potentiel hydrique devient trop bas et que les cellules foliaires perdent leur turgescence que l’expression «stress hydrique» prend sa signification. En période de stress hydrique, il y a généralement fermeture des stomates pour minimiser les pertes d’eau, ce qui limite également l’accès des cellules photosynthétiques au CO 2 atmosphérique. Le taux de photosynthèse des feuilles est alors diminué (Ellsworth et Reich, 1992) et lorsque la concentration en CO2 à l’intérieur des feuilles devient trop faible, l’enzyme responsable de la fixation du CO2 utilise plutôt du O2 dans un processus énergétiquement déficitaire appelé photorespiration (Devlin et Witham, 1983). Par son effet négatif sur la photosynthèse, la fermeture des stomates réduit donc la quantité d’hydrates de carbone disponibles pour la croissance des tissus, la production de substances de défense et l’entreposage des sucres récoltés dans la sève au printemps.
Les faibles potentiels hydriques observés en période de stress hydrique signifient que de fortes tensions sont appliquées aux colonnes d’eau à l’intérieur des vaisseaux du xylème. Ces tensions peuvent être assez fortes pour vaincre la force de cohésion de l’eau et résulter en un bris des colonnes d’eau (cavitation). Le phénomène de cavitation produit un vide à l’intérieur des vaisseaux, rapidement comblé par de l’air provenant des tissus environnants, d’où formation d’embolies (Sperry et Tyree, 1988). Une fois formées, ces embolies rendent les vaisseaux inutilisables pour le transport de l’eau des racines jusqu’aux feuilles, ce qui peut ralentir la réhydratation des tissus foliaires et allonger la période de fermeture des stomates. Tyree et Dixon (1986) ont déterminé que le phénomène de cavitation devenait important pour l’érable à sucre lorsque le potentiel hydrique des branches atteignait -3 MPa. De plus, Sperry et al. (1988) ont observé que le nombre de vaisseaux obturés, augmentait avec l’avancement de la saison de croissance et atteignait une très forte proportion pendant l’hiver en raison de la sublimation ou de l’évaporation de l’eau en absence d’absorption par les racines. Ce phénomène d’embolie n’est cependant pas irréversible, car la pression racinaire souvent observée au printemps chez l’érable à sucre peut permettre d’évacuer les gaz à l’intérieur des vaisseaux et ainsi les rendre à nouveau fonctionnels pour le transport de l’eau (Sperry et al., 1988).
Un symptôme de stress hydrique chez l’érable à sucre est l’enroulement des feuilles qui a d’ailleurs été observé au début des années 80 par Bernier et Brazeau (1988b). Ces auteurs ont noté que l’enroulement foliaire était plus prononcé sur les feuilles directement exposées au soleil et précédait parfois la mortalité des branches. En réaction à un stress hydrique, l’enroulement foliaire est une mesure adoptée par certaines espèces pour réduire leur superficie foliaire exposée au soleil et ainsi diminuer leur perte d’eau par transpiration (Turner, 1979, 1986). L’enroulement des feuilles est aussi un symptôme de carence en potassium (Bernier et Brazeau, 1988b), lequel intervient dans le processus de fermeture des stomates (Devlin. et Witham, 1983). Si un stress hydrique important survient au printemps ou que des dommages aux racines sont provoqués par un gel en profondeur du sol pendant l’hiver (Pomerleau, 1991), il est aussi possible que les feuilles d’érable à sucre soient de plus petites taille l’été suivant.
2.3.2 Sol
Claude Camiré
Dans son aire de distribution, l’érable à sucre s’accommode d’une gamme de sols quant à leur minéralogie (éléments nutritifs), leur texture et leur régime hydrique (Godman et al., 1990). Au plan pédogénétique, il se retrouve sur des brunisols, des podzols, des luvisols et des régosols. Au Québec, les sols frais, de texture moyenne et de pH légèrement acide à neutre (brunisols sombriques et mélaniques), seraient ceux sur lesquels sa croissance est la meilleure. Toutefois, les sols de l’érablière à bouleau jaune des basses Laurentides sont fortement acides (pH < 4,5) et de texture assez grossière (sable loameux à loam sableux) tandis que plusieurs sols des Appalaches sont lourds. La profondeur du sol et le type de matériel originel ont une influence marquée sur l'indice de station (Leak, 1978). L'érable à sucre ne croît pas bien sur les sols secs et minces (Godman, 1965) où il est périodiquement soumis à des stress hydriques.
On retrouve l’érable à sucre sur des sols ayant un pH variant ordinairement entre 5,5 et 7,3 (Godman, 1965). À des valeurs de pH comprises entre 4,5 et 7,0, la teneur en Ca du feuillage varie peu (de 15 à 25 g kg-1); mais si le pH est inférieur à 4,5, cette teneur diminue de façon marquée. À la station forestière de Duchesnay, où le pH de l’horizon Bhf1 est de 3,8 et celui de la couverture morte est d’environ 3,0, les concentrations foliaires en Ca sont de l’ordre de 4,1 g kg-1.
Lorsque les mouvements de l’eau du sol sont trop lents, les conditions d’engorgement qui en résultent nuisent aux échanges gazeux et provoquent une carence en O2. Dans ces conditions d’anoxie, il y a également production de méthane (CH4 ) et d’éthylène (C2H4), des produits qui sont toxiques pour les radicelles. En milieu acide, les conditions anaérobies favorisent l’accumulation de fer et de manganèse réduits (Fe++ et Mn++) à des concentrations toxiques (Kozlowski, 1985). Dans ces conditions, l’enracinement est superficiel et l’érable à sucre subit des stress hydriques en raison des conditions chimiques du sol.
Les études des années 80 liées au dépérissement des érablières, ont mis en évidence les facteurs édaphiques stressants de la forêt feuillue, notamment aux niveaux hydrique et nutritionnel. Il a été observé que les érablières sur sols minces (stress hydrique) ainsi que celles sur sols mal drainés (érablière à frêne noir [Fraxinus nigra Marsh.]) étaient celles qui dépérissaient en premier et celles où le taux de dépérissement était le plus élevé (Gagnon et Roy, 1993). Sur le plan nutritionnel, de nombreuses recherches ont mis en évidence des carences en P (Paré et Bernier, 1989) et surtout en K (Bernier et Brazeau, 1988a,b) dans les Appalaches ainsi qu’en Ca et surtout en Mg (Bernier et Brazeau, 1988c) dans les basses Laurentides. Dans le cas des Appalaches, les déficiences en K résultent d’un déséquilibre créé par un excès de Mg dans le sol (Ouimet et Camiré, 1995). Afin d’obtenir un statut nutritif équilibré, l’humus forestier devrait posséder moins de 10 % de Mg sur le complexe d’échange et des rapports de cations échangeables Ca/Mg > 6 et K/Mg > 0,5. Les niveaux pour l’horizon B minéral devraient se situer entre < 0,1 pour le rapport Mg/céc et > 1 pour les rapports K/Mg et Ca/(H + AI) (Ouimet et Camiré, 1995).
Dans les horizons minéraux, la toxicité de AI se manifesterait à des pH inférieurs à = 4,0 (Marquis et Camiré, 1994). À ce pH, le rapport Ca/Al monomérique inorganique de la solution du sol serait inférieur à 1, soit une valeur critique pour les plantes (Reuss et al., 1990; Joslin et Wolfe, 1988). Un excès de Al dans la solution du sol ralentit le prélèvement et le transport de Ca dans la plante (Andersson, 1988; Foy, 1988; Thornton et al., 1986). Dans les basses Laurentides, le climat et la nature du matériel originel (granite et gneiss) conduisent à la formation de sols très acides et pauvres en Ca et Mg (Camiré et Ouimet, 1994). Les essais de fertilisation ont montré qu’il était possible de corriger les carences nutritives dans les érablières (Côté et al., 1993; Paré et al., 1993; Hendershot, 1991; Ouimet, 1991; Bernier et al., 1989; Hendershot et Jones, 1989) et d’améliorer la croissance (Ouimet et Fortin, 1992).
2.3.3 Température
Francine Bigras
Les basses températures, la sécheresse et la salinité sont les principaux stress environnementaux qui limitent la productivité et la distribution des plantes sur la terre. La basse température est, dans nos régions, le facteur le plus important. Toutefois, en ce qui concerne l’érable à sucre, il existe peu de données sur la physiologie associée au froid et sur l’impact des basses températures. Les températures élevées se rencontrent à la limite sud de l’aire de distribution de cette espèce. Kriebel (1973) a distingué, à l’intérieur de l’aire de distribution de l’érable à sucre, trois écotypes différents quant au degré de résistance au froid et à la sécheresse: 1- l’écotype appalachien (nord-est canadien – états des Grands Lacs), susceptible à la chaleur et à la sécheresse et possédant un niveau élevé de tolérance au gel; 2- l’écotype de la région centrale américaine (sud du Michigan et ouest de l’Ohio jusqu’au sud du Minnesota et de l’Iowa), résistant à la chaleur et à la sécheresse, avec un niveau élevé de tolérance au gel; 3- l’écotype du sud (états côtiers du Sud et plaines du golfe du Mexique, vallée du Mississipi jusqu’au sud de l’Illinois), possédant une tolérance élevée à la chaleur et à la sécheresse et un niveau faible à modéré de tolérance au gel. Dans ce texte, nous traiterons essentiellement de l’influence des basses températures.
Mécanismes de résistance au gel
Les plantes ligneuses résistent au gel (présence de glace) en utilisant deux mécanismes physiologiques: le gel extracellulaire et la surfusion. Certaines espèces telles que le bouleau blanc (Betula papyrifera Marsh.) et le peuplier plantes ont évolué en tolérant la présence de la glace à l’extérieur des cellules. À l’automne, lorsque la température extérieure diminue, la solution aqueuse à l’extérieur des cellules, moins concentrée que celle à l’intérieur de celles-ci, gèle en premier. La pression de vapeur d’eau à l’extérieur des cellules est à ce moment moins élevée qu’à l’intérieur, ce qui entraîne un appel d’eau vers la glace. Ainsi, l’eau sort des cellules durant l’automne, provoquant une déshydratation, une augmentation de concentration à l’intérieur des cellules ainsi qu’une déformation des cellules. Toutefois, une cellule ainsi déshydratée peut supporter le gel. La glace formée à l’extérieur de la cellule ne cause pas, dans ce cas, de dommages aux cellules. Ce mécanisme physiologique permet d’atteindre les niveaux de tolérance au gel les plus élevés parmi les espèces ligneuses et fait en sorte que la distribution de ces espèces puisse s’étendre dans les régions extrêmement froides. Plus une plante peut supporter la déshydratation cellulaire (protoplasmes), plus celle-ci sera tolérante au gel et plus elle pourra étendre sa distribution vers les régions froides. Par contre, certaines espèces qui utilisent le mécanisme de gel extracellulaire ne pourront supporter une forte déshydratation cellulaire et verront leur distribution limitée aux régions plus clémentes. Le peuplier faux tremble et le bouleau blanc par exemple, peuvent étendre leur distribution jusqu’en zone de rusticité 1 tandis que le tilleul d’Amérique (Tilia americana L.) se verra limité à la zone 3 (zones de rusticité de Ouellet et Sherk, 1967).
D’autres espèces, comme l’érable à sucre, le frêne d’Amérique (Fraxinus americana L.) le hêtre à grandes feuilles (Fagus grandifolia Ehrh.) emploient deux mécanismes physiologiques à la fois pour tolérer le gel, soit le gel extracellulaire et la surfusion. La surfusion est cependant limitée à certaines cellules ou tissus. La surfusion de l’eau est la propriété par laquelle l’eau demeure sous forme liquide à des températures sous 0 °C. Ceci est possible pourvu que la goutte d’eau soit très petite et qu’aucune particule (substance nucléante active), agissant comme noyau de cristallisation, ne soit présente. Ces conditions se rencontrent dans les cellules parenchymateuses du xylème et dans les bourgeons floraux de certains arbres fruitiers. Toutefois, une eau en surfusion possède également la propriété de geler spontanément aux environs de -38 à -47 °C, ce qui entraîne la formation de glace à l’intérieur de la cellule et provoque la mort dans des conditions naturelles. En effet, la glace à l’intérieur de la cellule, en plus de briser la membrane cytoplasmique, détruit l’organisation cellulaire nécessaire aux processus vitaux. La mort de ces cellules n’entraîne pas la mort de l’arbre, mais l’entrée et l’envahissement des pathogènes dans les cellules mortes peuvent causer la mort de l’arbre à long terme. Ainsi, les espèces telles que l’érable à sucre, le noyer noir (Juglans nigra L.), le chêne à gros fruits (Quercus Macrocarpa Michx.), qui montrent une surfusion des cellules parenchymateuses du xylème, ne peuvent étendre leur distribution au-delà de l’isotherme de -40 °C (George et al., 1974.). L’érable à sucre voit donc sa distribution limitée au nord par le phénomène de surfusion et au sud par sa faible tolérance à la sécheresse et aux sols secs.
Acclimatation
Le passage de l’état sensible au gel en été à l’état tolérant au gel en automne se nomme l’acclimatation (ou endurcissement), tandis que la situation inverse s’appelle la désacclimatation (désendurcissement). L’acclimatation des parties aériennes se fait en réponse à la diminution de la longueur du jour et de la température. Dans le cas de l’érable à sucre où le degré de tolérance au gel ne dépasse pas -40 °C, on serait en présence de deux stades d’acclimatation des parties aériennes. Le premier stade s’effectue à la fin de l’été lorsque la longueur du jour diminue et que les températures de jour sont encore élevées; le niveau de tolérance au gel est cependant peu important à la fin de ce stade. La diminution de la longueur du jour provoque aussi l’arrêt de croissance, la formation des bourgeons et l’entrée en dormance. Le deuxième stade est indépendant de la longueur du jour; les températures voisines du point de congélation sont le déclencheur de ce stade où l’on atteint alors des degrés de tolérance au gel plus importants. En général, on s’entend pour dire que les plantes malades, déficientes en éléments minéraux ou possédant peu de réserves en hydrates de carbone, s’endurcissent moins que les plantes en bon état. Lindstrom (1990) a suivi la tolérance au gel de sept espèces décidues, Acer rubrum, Quercus alba, Fraxinus pennsylvanica, Liquidambar stryaciflua, Acer saccharum, Betula nigra et Prunus serotina, agées entre 20 et 40 ans, durant trois années consécutives en Georgie, à la limite sud de l’aire de distribution de l’érable à sucre. Il a montré que, pour l’érable à sucre dans ces conditions, on observait un endurcissement progressif à compter de la fin de septembre et que l’endurcissement maximal s’observait au début de décembre. Durant la période hivernale, l’érable à sucre peut se désendurcir à la suite de périodes plus clémentes.
Au Québec, Calmé et al. (sous presse) ont étudié, du 26 août 1992 au 10 mai 1993, la tolérance au gel des tiges et des racines et la dormance de semis de bouleau jaune (Betula alleghaniensis Britt.), de chêne rouge (Quercus rubra L.) et d’érable à sucre âgés de cinq mois et cultivés en contenants. Ces auteurs ont montré que l’endurcissement et la tolérance au gel des racines et des tiges étaient différents pour les trois espèces; le bouleau jaune était le plus tolérant, suivi de l’érable à sucre et finalement, du chêne rouge. Gregory et al. (1986) ont rapporté une diminution de la tolérance au gel de l’érable à sucre si l’on effectuait une défoliation précoce (24 juillet au 3 août), démontrant ainsi l’importance du feuillage dans le mécanisme de l’acclimatation. Les arbres défoliés ont également montré une diminution de l’amidon dans les tiges et les racines. La mortalité et le dépérissement subséquents ont été fortement associés à la faible teneur en amidon. Le désendurcissement des parties aériennes est fonction de la température. On n’a pas rapporté l’influence de la longueur du jour sur ce phénomène. Quant aux racines, il ressort présentement dans la littérature que pour les espèces ligneuses, l’acclimatation et la désacclimatation des racines se feraient en réponse à la température seulement.
Variations dans la tolérance au gel
Les mécanismes d’acclimatation et de désacclimatation nous permettent de constater que la tolérance au gel varie d’une saison à l’autre. De plus, il est important de noter qu’il existe des différences importantes dans les niveaux d’endurcissement des différentes parties d’un arbre. En général, les organes reproducteurs sont plus sensibles que les tissus végétatifs durant la saison de croissance. Les racines sont particulièrement sensibles au froid. Par exemple, pour Acer pseudoplatanus -nous ne possédons pas ce genre de données pour l’érable à sucre adulte -on constate qu’en hiver, le cortex et le cambium du tronc sont les tissus les plus résistants au gel tandis que les racines possèdent les tissus les plus sensibles. Au printemps, c’est le xylème du tronc qui devient le plus résistant. Steponkus et al. (1976) ont déterminé que la tolérance au gel des racines de semis d’érable à sucre cultivés en contenants se situait aux environs de -18 °C. Ces auteurs ne mentionnent toutefois pas le type de racines qui a été testé. Pour leur part, Calmé et al. (sous presse) ont montré pour des semis d’érable à sucre âgés de cinq mois et croissant en contenants, que 30 % de la masse des racines vivantes étaient intactes à -30°C au début du mois de décembre. En plus des variations de tolérance au gel entre les saisons et entre les tissus, il existe également des différences dans la tolérance au gel au cours du développement de la plante. Par exemple, le jeune semis de platane est peu résistant au froid au printemps lors de sa germination et il acquiert un peu de tolérance au moment de la sortie des premières feuilles. Dans le cas de l’érable à sucre, la tolérance au gel devient maximale à l’état adulte. À l’inverse, certaines espèces montrent des niveaux de résistance plus élevés à l’état de semis qu’à l’âge adulte.
Dommages causés par le gel
Les dommages par le gel peuvent survenir en automne à la suite d’un gel hâtif, avant que la plante ne se soit endurcie suffisamment ou que le niveau de tolérance n’ait atteint l’intensité du gel. Les gelées d’automne peuvent n’affecter que la croissance de l’année. Les dommages peuvent également survenir en hiver si le gel dépasse leur degré de tolérance ou la limite génétique de l’espèce. Les dommages d’hiver peuvent également survenir à la suite d’un désendurcissement causé par des températures anormalement élevées en hiver (redoux). Les dommages par les gelées tardives peuvent aussi survenir à la suite du débourrement printanier. Les gels printaniers de fortes intensités qui surviennent à la suite du débourrement peuvent entraîner la mort du feuillage et de la tige de l’année. Au printemps, parmi les essences feuillues au Québec, par ordre décroissant les frênes, les tilleuls et les peupliers, sont plus sensibles aux gelées tardives que les érables, les bouleaux et les hêtres (Lavallée, 1985). Des gels printaniers de plus faibles intensités au printemps, peuvent donner lieu à des trous dans le feuillage vert des espèces feuillues (Lavallée, 1985). Le gel peut également survenir au moment de la floraison. On sait que les fleurs sont, chez les espèces ligneuses, une partie extrêmement sensible au gel. Rast et Brisbin (1987) ont rapporté que la croissance radiale de l’érable à sucre avait diminué de 12 % l’année suivant un gel printanier.
Il ressort de ce qui précède que les connaissances sur la tolérance au gel de l’érable à sucre sont très limitées. Il serait intéressant d’étudier, entre autres, l’acclimatation et la désacclimatation, les degrés de tolérance des différents tissus et organes et l’impact de la surfusion. Ces connaissances serviraient par la suite à évaluer l’impact des pratiques sylvicoles ou des traitements de fertilisants sur la tolérance au gel.
2.3.4 Polluants atmosphériques
Gilles Robitaille
Au Québec les polluants atmosphériques ayant le plus de possibilités de causer des dommages à l’érable à sucre sont l’ozone (O3 ), le bioxide de soufre (SO2) et les précipitations acides. L’action de ces polluants sur l’érable est plus ou moins important selon la dose de polluants reçue. Les mécanismes d’action des polluants, par effets directs ou indirects, sont les conséquences du type de polluant, de la concentration, ainsi que du mode d’entrée du polluant.
Les polluants atmosphériques gazeux affectent la photosynthèse, la respiration et les réactions enzymatiques de l’érable à sucre. Ceci a une influence sur la croissance de l’érable. L’exposition au polluant ou à la dose (concentration de polluant x le temps d’exposition au polluant) de polluant reçue est un facteur important (Krupa et Kickert, 1987). Si l’érable reçoit une concentration élevée de polluant sur une courte période de temps, nous parlons d’une dose aiguë. Par contre, si sur une longue période de temps la concentration de polluant reçue est faible, nous parlons d’une dose chronique. Les effets d’une dose aiguë sont généralement visibles et relativement faciles à observer. Les symptômes sur les feuilles sont des chloroses et des nécroses. Les effets d’une dose chronique sont souvent invisibles ou subliminaires alors qu’elle agit surtout sur le métabolisme de l’érable. Dans certains cas, le rapport racine/tige est affecté.
Les précipitations acides agissent directement sur la cuticule de la feuille. En effet, à la suite d’une exposition à des précipitations acides, la cuticule devient plus mince, exposant ainsi le parenchyme palissadique aux polluants atmosphériques gazeux et aux pathogènes. Le lessivage des éléments nutritifs dans la feuille et dans le sol peut causer des carences nutritives chez l’érable à sucre, ce qui peut réduire sa croissance (section 2.2.4).
Hibben (1969) est un des premiers chercheurs à avoir étudié les effets de l’ozone sur l’érable à sucre. Tout en décrivant les symptômes causés par l’ozone, il arrive à la conclusion que l’ozone puisse affecter la croissance de l’érable sans nécessairement causer des symptômes visuels, c’est-à-dire qu’il se produit des modifications physiologiques, cellulaires et subliminaires.
Plusieurs facteurs de l’environnement immédiat de la plante ont le potentiel d’augmenter ou de diminuer les effets physiologiques et l’expression des symptômes des polluants atmosphériques. La température, la lumière, l’approvisionnement en eau, le vent, la concentration de CO2 et le statut nutritif de la plante sont les plus importants. La quantité et la qualité de la lumière reçue par l’érable en sont aussi un exemple. L’érable à sucre de la strate dominante n’a besoin que d’une faible intensité lumineuse (RAP, radiations actives photosynthétiquement) d’environ 600 mol s-1 m-2 (la pleine intensité du soleil est de 2 000 mol s-1 m-2) pour atteindre un taux de photosynthèse maximal (Reich et al., 1991). L’activité photosynthétique de l’érable à sucre est faible. Elle varie entre 4,2 mg CO2 dm-2 h-1 à 7,0 mg CO2 dm-2 h-1 en fonction de l’intensité lumineuse, de la température de l’air et de la feuille, de l’humidité relative et de la position de la feuille dans la cime (Logan et Krotkov, 1968; Ledig et Korboro, 1983; Reich et al., 1983, 1986). Carlson (1977) a observé que le bioxide de soufre pouvait inhiber d’avantage l’activité photosynthétique de l’érable à sucre à un faible niveau de RAP (600 mol s-1 m-2 ) qu’à une plus forte intensité (2 000 mol s-1 m-2). Tjoelker et al., (1993) et Volin et al., (1993) ont observé in situ que les semis d’érables poussant dans des endroits ombragés sont plus sensibles à une concentration d’ozone ambiante que les semis poussant en plein soleil. Cette observation est très importante si l’on considère que l’érable est une espèce qui a besoin d’un milieu ombragé pour s’établir en sous-bois.
Le stade physiologique des feuilles de l’érable a une influence sur la sensibilité à l’ozone. Hibben (1969) a observé que les jeunes feuilles de l’érable à sucre étaient moins sensibles à l’ozone que des feuilles plus vieilles. Les sauvageons d’érables à sucre de deux à cinq ans sont relativement tolérants à des doses aiguës d’ozone surtout lorsque les feuilles sont immatures (Wood, 1970). Davis et Wilhour (1976) considèrent que l’érable à sucre est moins sensible à l’ozone que le frêne d’Amérique et le chêne blanc (Querus alba L.). Karnosky (1981) a observé que l’érable à sucre, exposé à 500 ppb d’ozone et à 1000 ppb de bioxide de soufre, séparément ou en combinaison, était plus tolérant que le frêne et d’autres espèces d’érables. Hibben (1969) a établi que le seuil de sensibilité à l’ozone de l’érable à sucre serait d’environ 200 ppb. Selon Jensen (1973), la croissance de l’érable est réduite de façon significative à la suite d’une dose de 300 ppb pendant cinq mois. Ces résultats diffèrent de ceux de Wood et Davis (1969) et il semble que les effets de l’ozone sur l’érable à sucre soient très variables (Hibben, 1969; Reich et al., 1986). Ceci pourrait être une manifestation de la variabilité génétique de l’érable (Krieble, 1957).
Par contre, Reich et Amundson (1985) ont démontré que des concentrations ambiantes d’ozone causent une réduction de la photosynthèse chez plusieurs espèces forestières incluant l’érable à sucre. Ces auteurs ont également observé qu’un traitement avec des solutions acides, seules ou en combinaison avec l’ozone, n’avait aucun effet sur la photosynthèse des espèces forestières. Les espèces dont la conductivité stomatique est élevée, c’est-à- dire avec un potentiel plus élevé d’absorber un polluant gazeux, sont les plus sensibles à l’ozone. En comparant les effets de l’ozone et ceux des pluies acides sur l’érable et le chêne, Reich et al. (1986) ont observé une réduction significative de la photosynthèse chez ces deux espèces, uniquement en réponse aux traitements d’ozone à 120 ppb. De plus, seul l’érable à sucre montrait des réductions de croissance en réponse au traitement d’ozone. Cette confirmation de leurs observations antérieures démontre que l’érable à sucre est relativement peu sensible aux retombées acides et davantage sensible à l’ozone. Jensen et Dochinger (1989), en exposant une dizaine d’espèces forestières à des combinaisons d’ozone, de bioxide de soufre et de dépôts acides, ont eux aussi démontré que l’érable à sucre était plus sensible à l’ozone et au bioxide de soufre qu’aux dépôts acides. L’effet des dépôts acides est surtout important dans le cycle des éléments nutritifs et du lessivage de certains éléments des feuilles de la cime. En effet, Lovett et Hubbell (1991) ont observé que des concentrations d’ozone variant de 25 ppb à 140 ppb n’avaient aucune influence sur les échanges cationiques des feuilles dans la cime de l’érable. Par contre, le traitement des feuilles avec un aérosol acide à pH 3,8 a doublé le lessivage du calcium et du magnésium comparativement à un traitement avec un aérosol à pH 5,0. Les effets négatifs de certains polluants sur l’érable à sucre sont déterminés par les conditions environnementales dans lesquelles se trouve l’arbre et, par conséquent, par son état physiologique.
En conclusion, l’ozone est le polluant qui a le plus de potentiel à affecter la vitalité et la croissance de l’érable à sucre, une espèce qui réagit négativement à de faibles concentrations d’ozone d’environ 120 à 300 ppb. En réponse à ce type de stress, il y a réduction de la photosynthèse et de la croissance racinaire et foliaire. Des mélanges d’ozone et de bioxide de soufre peuvent augmenter la sensibilité de l’érable. Le lessivage de certains éléments nutritifs des feuilles de la cime de l’érable est surtout un effet des précipitations acides. Ce lessivage n’est pas influencé par les concentrations ambiantes ou élevées d’ozone. Certaines conditions environnementales peuvent augmenter la sensibilité de l’érable à l’ozone.
Bibliographie
Alli, T. J., J. Bourque, R. Metassin, R. Liang et V. Yaylayan, 1990. Identification of pyrazine in maple sirup. J. Agric. Food Chem. 38: 1242-1244.
Amthor, J. S., D. S. GUI, et IL Bormann, 1990. Autumnal leaf conductance and apparent photosynthesis by saplings and sprouts in a recently disturbed northern hardwood forest. Oecol. 84: 93-98.
Andersson, M., 1988. Toxicity and tolerance of aluminium in vascular plants – A literature review. Water Air Soil Pollut. 39: 439-462.
Baucher, S., 1994. Répertoire des arbres remarquables du Québec. Érable à sucre. Forêt Conservation.
Beaton, J. D., 1978. Fertilizer methods and applications to forestry practice. Forest fertilization. Symposium Proceedings, USDA For. Serv., Rep. NE-3: 19-36.
Bellefleur, P. et G. Larocque, 1983. Comparaison de la croissance d’espèces ligneuses en milieu ouvert et sous couvert forestier. Can. J. For. Res. 13: 508-513.
Bernier, B. et M. Brazeau, 1988a. Foliar nutrient status in relation to sugar maple dieback and decline in the Quebec Appalachians. Can. J. For. Res. 18: 754-761.
Bernier, B. et M. Brazeau, 1988b. Nutrient deficiency symptoms associated with sugar maple dieback and decline in the Quebec Appalachians. Can. J. For. Res. 18: 762-767.
Bernier, B. et M. Brazeau, 1988c. Magnesium deficiency symptoms associated with sugar maple dieback and decline in a Lower Laurentians site in southeastern Quebec. Can. J. For. Res. 18: 1265-1269.
Bernier, B. et M. Brazeau, 1988d. An occurence of boron deficiency in the deciduous forest of the Quebec Appalachians and the St. Lawrence Lowlands. Can. J. Soil Sci. 71: 275-276.
Bernier, B., D. Paré et M. Brazeau, 1989. Natural stresses, nutrient imbalances and forest decline in Southeastern Quebec. Water Air Soil Pollut. 48: 239-250.
Bertrand, A., G. Robitaille, P. Nadeau et R. Boutin, 1994. Effects of soil freezing and drought stress on abscisic acid content of sugar maple sap and leaves. Tree Physiol. 14: 413-425.
Bicknell, S. H., 1982. Development of canopy stratification during early succession in northern hardwood. For. Ecol. Manag. 4: 41-51.
Bohn, H. B., B. McNeal et G. O’Connor, 1985. Soil Chemistry, 2n’ ed., John Wiley and Sons, New York, 341 p.
Calmé, S., F. J. Bigras, H. A. Margolis et C. Hébert, 1994. Frost tolerance and bud-dormancy of container-grown yellow birch, red oak and sugar maple seedlings. Tree Physiol, 14: 1313-1325.
Camiré, C. et R. Ouimet, 1990. La fertilisation opérationnelle des érablières en dépérissement. Dans: Camiré, C., W. Hendershot et D. Lachance (éd.). Le dépérissement des érablières, causes et solutions possibles. C.R.B.F., Fac. for. géorn., Univ. Laval, Québec: 169-175.
Camiré, C. et R. Ouimet, 1994. Nutrient soil pools in a sugar maple stand in the Low Laurentides. Can. J. Soil Sci. 74: 350.
Carlson, & W., 1977. Reduction in the photosynthetic rate of northern hardwood species caused by sulfur dioxide and ozone. Michigan Univ. Microfilms Int. Ann Arbour, Michigan, 86.
Castonguay, Y., P. Nadeau, P. Lechasseur et L. Chouinard, 1995. Differential accumulation of carbohydrates in alfalfa cultivars of contrasting winterhardiness. Sous presse à Crop Science.
Chazdon, R. L., 1988. Sunflecks and their importance to forest understory plants. Adv. Ecol. Res. 18: 1-63.
Cole, D.W. et M. Rapp,1981. Elemental cycling in forest ecosystems. Dans: Reichle, D. E. (éd.), Dynamic properties of forest ecosystems, IBP Progr. 23, Cambridge Univ. Press, Cambridge: 341-410.
Côté, B., W. H. Hendershot et I. O’Halloran, 1993. Response of sugar maple to seven types of fertilization in Southern Quebec: Growth and nutrient status. Dans: Huettl, R. F. and D. Mueller-Dombois (éd.). Forest Decline in the Atlantic and Pacifie Region. Springer-Verlag, Berlin: 162-174.
Crowe, J. H., J. F. Carpentier, L. M. Crowe et T. J. Anchordoguy, 1990. Are freezing and dehydration similar stress vectors? A comparison of modes of interaction of stabilizing solutes with biomolecules. Cryobiol. 27: 219-231.
Davis, D. D., et R. G. Wilhour, 1976. Susceptibility of woody plants to sulfur dioxide and photochemical oxidants. A literature review. Corvallis Environ. Res. Lab. US EPA, EPA-660/3: 76-102.
Devlin, R. M. et F. H. Witham, 1983. Plant physiology, 4th ed. Wadsworth Publishing Company, Belmont, California, U.S.A.
Dumbroff, E. B., D. B. Cohen et D. P. Webb, 1979. Seasonal levels of abscisic acid in buds and stems of Acer saccharum. Physiol. Plant. 45: 211-214.
Ellsworth, D. et P. Reich, 1992. Water relations and gas exchange of Acer saccharum seedlings in contrasting natural light and water regime. Tree Physiol. 10: 1-20.
Foster, N. W., 1. K. Morrison, X. Yin et P. A. Arp, 1992. Impact of soil water deficits in a mature sugar maple forest: stand biochemistry. Can. J. For. Res. 22: 1753-1760.
Foy, C. D., 1988. Plant adaptation to acid, aluminum-toxic soils. Commun. Soil Sci. Plant Anal. 19: 959-987.
Foy, C. D., R. L. Chaney et M. C. White, 1978. The physiology of metal toxicity in plants. Annu. Rev. Plant Physiol. 29: 511-566.
Gagnon, G. et G. Roy, 1993. L’observation du dépérissement: une approche régionale basée sur l’écosystème. Dans: Comptes rendus du colloque «La recherche sur le dépérissement: un premier pas vers le monitoring des forêts». Min. des forêts, Gouv. du Québec, Québec: 21-29.
Gagnon, G., L. Robitaffle, G. Roy et C. Gravel, 1985. Le dépérissement des érablières. comportement de certaines variables écologiques. La Terre de Chez Nous (dossier) 3(5), 28 mars.
Gagnon, G., G. Roy, C. Gravel etj. Gagné, 1986. État des recherches sur le dépérissement au Ministère de l’Énergie et des Ressources. Dépérissement des érablières. Cahier de conf. AGDEX 300/637, Québec: 47-85.
George , M. F., M. J. Biirke, H. M. Pellett et A.G. Johnson, 1974. Low temperature exotherms and woody plant distribution. HortScience 9:519-522.
Godman, R. M., 1965. Sugar maple (Acer saccharum Marsh.). Dans: Fowells, H. A. (Comp.). Silvics of Forest Trees of the United States. Agric. Handbook 27 1. USDA, Washington, DC: 66-73.
Godman, R. M., H. W. Yawney et C. H. Tubbs, 1990. Acer saccharum Marsh. – Sugar maple. Dans: Burns, R. M. and B. H. Honkala (Comp.). Silvics of North America. Vol. 2, Hardwoods. Agric. Handbook 654. USDA, Washington, DC: 78-91.
Gregory, R. A., 1980. Annual cycle of shoot development in sugar maple. Can. J. For. Res. 10: 316-326.
Gregory, R. A., M. W. Williams jr., B. L. Wong et G. J. Hawley, 1986. Proposed scenario for dieback and decline of Acer saccharum in northeastern U.S.A. and southeastern Canada. Int. Assoc. Wood Anat. Bull. 7:357-369.
Hendershot, W., 1989. Réponse des érables à sucre à la fertilisation dans la région de Beauce-Mégantic. Colloque: Atelier sur le dépérissement des érablières. SaintHyacinthe, Québec, Canada, 23-24 fév.
Hendershot, W., 1991. Fertilization of sugar maple showing dieback symptoms in the Quebec Appalachians. Fert. Res. 27: 63-70.
Hendershot, W. et A. R. C. Jones, 1989. Maple decline in Quebec. A discussion of possible causes and the use of fertilizers to limit damage. For. Chron. 65: 280-287.
Hibben, C. R., 1969. Ozone toxicity to sugar maple. Phytopathology 59:1423-1428.
Jensen, K. F., 1973. Response of nine forest tree species to chronic ozone fumigation. Plant Disease Rep. 57: 914- 917.
Jensen, K. F. et L. S. Dochinger, 1989. Response of eastern hardwood species to ozone, sulfur dioxide and acid precipitation. JAPCA 39: 852-855.
Johnson, & W., M. Tyree et M. A. Dixon, 1987. A requirement for sucrose in xylem sap flow from dormant maple trees. Plant Physiol. 84: 495-500.
Joslin, J. D. et M. H. Wolfe, 1988. Responses of red spruce seedlings to changes in soil aluminum in six amended forest soil horizons. Can. J. For. Res. 18: 1614-1623.
Karnosky, D. F., 1981. Chamber and field evaluations of air pollution tolerances of urban trees. J. Arboric. 7: 99-105.
Kozlowski, T. T., 1985. Soil aeration, flooding, and tree growth, J. Arboric. 11: 85-96.
Kozlowski, T. T et R. C. Ward, 1957. Seasonal growth of deciduous trees. For. Sci. 3: 168-174.
Kriebel, H. B., 1957. Patterns of genetic variation in sugar maple. Ohio Agricul. Exp. Sta. Res. Bull. 791, 56 p.
Kriebel, H. B, 1973. Selection and breeding of sugar maple. Research Summary, Ohio Agric. Res. and Dev. Center, n’ 70: 7-8.
Krupa, S. et R. N. Kickert, 1987. An analysis of numerical models of air pollutant exposure end vegetation response. Environ. Pollut. 44: 127-158.
Lavallée, A., 1985. Dessiccation hivernale et gelure printanière. Feuillet d’information, Centre de rech. for. des Laurentides, Gouv. du Can., Serv. can. des forêts, 4 p.
Lea, R., W. C. Tierson, D. H. Bickelhaupt et A. L Leaf, 1979a. Stand treatment and sampling time of hardwood foliage. I. Macro-element analysis. Plant Soil 51: 515-533.
Lea, R., W. C. Tierson, D. H. Bickelhaupt et A. L. Leaf, 1979b. Stand treatment and sampling time of hardwood foliage. II. Micro-element analysis. Plant Soil 51: 535-550.
Leak, W. B., 1978. Relationships of species and site index to habitat in the White Mountains of New Hampshire. Res. Pap. NE-143. USDA For. Serv., Northeastern Forest Exp. Stn, Upper Darby, PA, 34 p.
Ledig, F. T. et D. R. Korboro, 1983. Adaptation of sugar maple populations along altitudinal gradients: photosynthesis, respiration, and specific leaf weight. Am. J. Bot. 70: 256-265.
Lindstrom, O. M., 1990. Weekly cold hardiness levels of seven deciduous hardwoods over three winter semons. HortScience 25:1143 (résumé).
Logan, K. T. et G. Krotov, 1968. Adaptations of the photosynthetic mechanism of sugar maple (Acer saccharum) seedlings grown in various light intensities. Physiol. Plant. 22: 104-116.
Lovett, G. M. etj. G. Hubbell, 1991. Effects of ozone and acid mist on foliar leaching frora eastern white pine and sugar maple. Can. J. For. Res. 21: 794-802.
Mader, D. L. et B. W. Thompson, 1969. Foliar and soil nutrients in relation to, sugar maple decline. Soil Sci. Soc. Amer. Proc. 33: 794-800.
Mahendrappa, M. K., N. W. Foster, G. F. Weetman et H. IL Krause, 1986. Nutrient cycling and availability in forest soils. Can. J. Soil Sci. 66: 547-572.
Marquis, F. et C. Candré, 1994. Les extraits de sols saturés à l’eau et le suivi des nutriments dans l’érablière dépérissante. Can. J. Soil Sci. 74: 247-255.
Morrison, I. K., 1985. Effect of crown position on foliar concentrations of 11 elements in Acer saccharum and Betula alleghaniensis trees on a till soil. Can. J. For. Res. 15: 179-183.
Morselli, M. F., J. W. Marvin et F. M. Laing, 1978. Image-analyzing computer in plant science: more and larger vascular rays in sugar maples of high sap and sugar yield. Can. J. Bot. 46: 983-986.
Ouellet, C. E. et L. C. Sherk, 1967. Suitability map for the probable winter survival of ornemental trees and shrubs. Can. J. Plant Sci. 47: 351-358.
Ouellet, L., D. Carrier, M. Rompré, G. Lafianune et M. Gagnon, 1991. Les sols dérivés de tills du comté de Beauce. Agrosol 4: 5-19.
Ouimet, R., 1990. Variation du statut nutritif de l’érablière en relation avec la disponibilité des éléments minéraux dans les horizons superficiels du sol. Dans: Camiré, C., W. Hendershot et D. Lachance (éd.). Le dépérissement des érablières, causes et solutions possibles. C.R.B.F., Fac. for. géom., Univ. Laval, Québec, Québec, Canada: 181- 188.
Ouimet, R., 1991. La fertilisation des érablières dépérissantes: résultats encourageants dans la Beauce et l’Estrie. Agrosol 4: 62-68.
Ouimet, R. et C. Carniré, 1991. Estimation of optimum foliar mineral nutrient concentrations for sugar maple in natural stands in Quebec by modeling the soil-foliar mineral concentration relationships. Can J. Soil Sci. 71: 275- 276.
Ouimet, R. et C. Camiré, 1993. Foliar deficiencies of sugar maple stands associated with soil cation imbalances in southeastern Quebec. (Soumis à Plant and Soil).
Ouimet, R. et J.-M. Fortin, 1992. Growth and foliar nutrient status of sugar maple: incidence of forest decline and reaction to fertilization. Can. J. For. Res. 22: 699-706.
Ouimet, R. et C. Camiré, 1995. Foliar deficiencies of sugar maple stands associated with soil cation imbalances in the Quebec Appalachians. Can. J. Soil Sci. 75 (sous presse).
Pagé, F., A. Sauvesty, B. Badibanga et C. Ansseau, 1993. Impacts des mauvaises saisons de croissance (1976- 1986) sur le dépérissement des érablières des milieux pédologiques pauvres du Québec. Agrosol 5: 5-9.
Paré, D. et B. Bernier, 1989. Origin of the phosphorus deficiency observed in declining sugar maple stands in the Quebec Appalachians. Can. J. For. Res. 19: 24-34.
Paré, D., W. L. Meyer et C. Camiré, 1993. Nutrient availability and foliar nutrient status of sugar maple saplings following fertilization. Soil Sci. Soc. Am. J. 57: 1107-1114.
Pereira, J. S. et T. T. Kozlowski, 1977. Influence of light intensity, temperature, and leaf area on stomatal aperture and water potential of woody plants. Can. J. For. Res. 7: 145-153.
Pomerleau, R., 1991. Expériences sur les mécanismes du dépérissement des forêts de feuillus au Québec. For. Can., région du Québec, rap. d’inf. LAU-X-96F.
Rast, E. D. et R. L. Brisbin, 1987. Six-year effects of two late spring frosts on Appalachian hardwoods. Northern J. Appl. For. 4:26-28.
Raymond, R. G. Laflamme et G. Godbout, 1976. Pédologie du comté de Portneuf. Service des sols, MAPAQ, Bull. tech. n° 18.
Reich, P. B. et R. G. Amundsun, 1985. Ambient levels of ozone reduce net photosynthesis in tree and crop species. Science 230: 566-570.
Reich, P. B., A. W. Schoettle, R. G. Amundson et J. Troiano, 1983. Effects of low concentrations of O3 and simulated acidic rain on net photosynthesis in sugar maple. Proceed. Second New York State Symp. Atinos. Depos., Albany, NY: 115-121.
Reich, P. B., A. W. Schoettle, et R. G. Amundson, 1986. Effects of O3 and acidic rain on photosynthesis and growth in sugar maple and northern red oak seedlings. Physiol. Plant. 63: 58-64.
Reich, P. B., M. B. Walters et D. S. Ellsworth, 1991. Leaf age and season influence the relationships between leaf nitrogen, leaf mass per area and photosynthesis in maple and oak trees. Plant Cell Environ. 14: 251-259.
Reuss, J. O., P. M. Wathall, E. C. Roswali et R. W. E. Hopper, 1990. Aluminum solubility, calcium-aluminum exchange, and pH in acid forest soils. Soil Sci. Soc. Am – J. 54: 374380.
Sakai, A., 1966. Studies of frost hardiness in woody plants. IL Effect of temperature on hardening. Plant Physiol. 41: 353-359.
Sauter, J. J. et B. Van Cleve, 1991. Biochemical and ultrastructural results during starchsugar-conversion in ray parenchyma cells of Populus during cold adaptation. J. Plant Physiol. 139: 19-26.
Sauvesty, A., F. Pagé et M. Giroux, 1993. Impacts des milieux pédologiques en bosses et creux sur les teneurs en composés phénoliques et en éléments minéraux dans les feuilles d’érables à sucre (Acersaccbarum) en dépérissement du Québec. Can. J. For. Res. 23: 190-198.
Sperry, J. S. et M. T. Tyree, 1988. Mechanism of water stress-induced xylem embolism. Plant Physiol. 88: 581-587.
Sperry, J. S., J. R. Donnelly et M. T. Tyree, 1988. Seasonal occurrence of xylem embolisrn in sugar maple (Acer saccharum). Amer. J. Bot. 75: 1212-1218.
St-Julien, P. et C. Hubert, 1975. Evolution of Taconian orogen in the Quebec Appalachians. Am. J. Sci. Ser. A, 275: 337-362.
Steponkus, P. L., G. L. Good et S. C. Wiest, 1976. Root hardiness of woody plants. American Nurseryman 144; 16 et 76-79.
Tamm, C. O., 1974. Kalkproblemet for jord, skog och miljovard. II Skog. Skogs- o. Lantbr.akad. Tidskr. 113: 37-43.
Taylor, J. S. et E. B. Dumbroff, 1975. Bud, root and growth regulator activity in Acer saccharum during the dormant season. Can. J. Bot. 53: 321-331.
Thorton, F. C., M. Schaedle et D. J. Raynal, 1986. Effect of aluminum on the growth of sugar maple in solution culture. Can. J. For. Res. 16: 892-896.
Tjoelker, M. G., J. C. Vélin, J. Oleksyn et P. B. Reich, 1993. Light environment alters response to ozone stress in seedlings of Acer saccharum Marsh. and hybrid Populus L. 1. In situ net photosynthesis, dark respiration and growth. New Phytol. 124: 627-636.
Toutain, F., A. Diagne et F. Le Tacon, 1987. Effets d’apports d’éléments minéraux sur le fonctionnement d’un écosystème forestier de l’est de la France. Rev. Ecol. Biol. Sol. 24 (3): 283-300.
Turner, N. C., 1979. Drought resistance and adaptation to water deficits in crop plants. Dans: Mussel, H. et R.C. Staples (éd.). Stress physiology in crop plants. John Wiley and Sons, New York: 343-372.
Turner, N. C., 1986. Crop water deficits: a decade of progress. Adv. Agron. 39: 1-51.
Tyree, M., 1984. Maple sap exudation: How it happens. Maple Syrup journal, 4: 10-11.
Tyrec, M. T. et M. A. Dixon, 1986. Water stress induced cavitation and embolism in some woody plants. Plant Physiol. 66: 397-405.
van Den Driessche, R., 1974. Prediction of mineral nutrient status of trees by foliar analysis. Bot. Rev. 40: 347-394.
Volin, J. C., M. G. Tjoelker, J. Oleksyn et P. B. Reich, 1993. Light environment alters response to ozone stress in seedlings of Acer saccharum Marsh. and hybrid Populus L. II. Diagnostic gas exchange and leaf chemistry. New Phytol. 124: 637-646.
Wargo, P. M., 1971. Seasonal changes in carbohydrate levels in roots of sugar maple. USDA For. Ser., Res. Paper NE-213.
Weetman, G. F. et S. B. Hill, 1978. General environmental and biological concerns in relation to forest fertilization. Forest fertilization. Symposium Proceedings, USDA For. Serv., Rep. NE-3: 19-36.
Whittaker, ILH., G. E. Likens, F. H. Bormannj. S. Eaton et T. G. Siccama, 1979. The Hubbard Brook ecosystem study: forest nutrient cycling and element behavior. Ecology 60: 203-220.
Wood, F. A., 1970. The relative sensitivity of sixteen deciduous tree species to ozone. Phytopathology 60: 579-580.
Wood, F. A. et D. D. Davis, 1969. Sensitivity of various deciduous tree species to ozone and sulfur dioxide. Phytopathology 59: 129-136.
Wright, J., H. Poitras et G. Lavoie, 1988. Étude sur la fertilisation et le chaulage des érablières. Rapports 1 et 2, déposés à l’Entente Auxiliaire Canada-Québec sur le développement Agro-Alimentaire. Dossier IAI 62515 250-007.
Yanai, R. D., 1992. Phosphorus budget of a 70-year-old northern hardwood forest. Biogeochemistry 17: 1-22.
Yang, S. et M. T. Tyree, 1993. Hydraulic resistance in Acer saccharum shoots and its influence on leaf water potential and transpiration. Tree Physiol. 12: 231242.
Zhangj, D. J. Gowing et W. J. Davies, 1990. ABA as a root signal in root to shoot communication of soil drying. Dans: Davies, W. J. et B. jefféoat (éd.). Importance of root to shoot communication in the response to environmental stress. British Society for Plant Growth Regulation, Bristol: 163-174.
Partie II L’érablière
3 Notions d’écosystéme
Michel Thibault
Ce chapitre vise à éclairer notre perception et notre compréhension de la forêt en tant qu’écosystème forestier en nous en donnant une vision la plus globale possible, tant par l’ensemble des facteurs qui en conditionnent le développement que par leurs propriétés ou caractéristiques les plus essentielles.
Nous verrons d’abord la signification même des concepts d’écosystème et d’écosystème forestier, puis les différents types de facteurs de l’environnement physique liés au développement de l’écosystème dont quelques-uns de leurs principaux rapports avec la végétation des érablières à sucre.
L’argumentation reposera essentiellement sur l’équation de base du fonctionnement des écosystèmes (Jenny, 1980; Gérardin, 1989) ainsi que sur le classement de Fanta (1985) pour ce qui est de l’ensemble des facteurs agissant sur l’écosystème.
Les principales notions de l’écosystème forestier qui seront développées en rapport avec les érablières sont la richesse spécifique qui n’est qu’un des nombreux volets de la biodiversité, la succession écologique dont quelques changements qui surviennent au sol et plus particulièrement à l’humus et, finalement, celles du climax et de la résilience.
3.1 Définition Du Concept
Utilisé par le botaniste Tansley, le terme écosystème réfère à l’association d’une communauté vivante (biocénose) avec son environnement physique (biotope). Il est dérivé du terme “éco” rappelant l’écologie, la science qui étudie les relations des êtres vivants avec leur milieu, associé au mot système qui fait référence à tout ensemble structuré en sciences exactes ou naturelles.
«N’importe quel ensemble incluant tous les organismes d’un espace donné, lesquels interagissent avec l’environnement physique et dont le flux d’énergie conduit à une structure trophique bien définie, une diversité biotique et à des cycles d’éléments (c’est-à-dire à l’échange de matériaux entre les parties vivantes et non vivantes à l’intérieur du système) est un système écologique ou un écosystème.» (Odum,1976). Les dimensions fonctionnelles et dynamiques sont donc très importantes pour l’écosystème.
3.2 Facteurs Agissant Sur L’écosystème
Fanta (1985) les regroupe en trois grandes catégories: les facteurs primaires et secondaires d’habitat et les facteurs de croissance (tableau 3.1). Il retient de l’habitat la définition qu’en donnent Walter (1960), Krajina (1960), Zlatnik (1973) et Kreutzer (1979, 198 1), à savoir: «la totalité des facteurs du milieu physique qui, à un certain endroit, influent de façon durable sur l’existence des plantes ou des associations végétales.» Ce concept équivaut à celui du biotope que Delpech et al. (1985) définissent comme: «l’ensemble des facteurs physiques caractérisant un écosystème ou une station.».
Tableau 3.1 Reproduction schématique des relations entre les facteurs primaires (externes) et secondaires (internes) du biotope, les facteurs de croissance et la végétation forestière (n’est pas disponible)
3.2.1 Les facteurs primaires du biotope
Les facteurs primaires sont à l’origine du développement des écosystèmes. Ils leur sont indépendants, de sorte que le contrôle qu’ils exercent sur la végétation est comme externe, extérieur à cette dernière. Fanta (1985) les regroupe en quatre grandes catégories: le climat, la topographie et l’orographie (relief), le matériel mère et enfin, les eaux souterraines et de surface.
Les trois premiers types de facteurs entrent dans l’équation fondamentale illustrant le fonctionnement des écosystèmes. Gérardin (1989) y ajoute en plus le facteur humain. En considérant en plus l’influence des eaux souterraines sur bon nombre d’écosystèmes, la dite équation pourrait alors s’écrire ainsi: E= f (C, R, M, A, B, T, H) où C: climat; R: relief; M: matériel meuble ou rochemère pédologique; A: eaux souterraines; B: stock biologique; T: temps; H: influence humaine. Les facteurs A et H n’agissent pas nécessairement sur tous les écosystèmes.
Le climat (C) détermine les conditions de temps et ses variations (température, précipitations, etc.). Le relief (R) contribue au climat, intervient dans le rayonnement solaire et, par conséquent, dans l’évaporation et l’évapotranspiration des plantes de même que dans le régime hydrique des stations, etc. La rochemère (M), par ses caractéristiques physiques et chimiques, est à l’origine de la fertilité première du sol; sa granulométrie et sa texture conditionnent en partie le drainage interne de ce dernier. Les eaux souterraines (A) influencent surtout les stations situées au bas des versants et des vallées, en contribuant à leur hydromorphie et aux apports de minéraux en provenance des formations du sous-sol. Elles peuvent provenir de nappes si profondes et si importantes que leur écoulement soit presque constant sur une base annuelle.
Cela résume l’importance ou les rôles des facteurs primaires du biotope. Quant au facteur stock biologique (B), difficilement prévisible, il peut être considéré comme constant à la toute origine du développement de l’écosystème. Dans le cas des successions secondaires, il dépendra des conditions mêmes de la station ainsi que de son environnement immédiat ou même éloigné. Le facteur temps (T), rend compte du temps écoulé depuis la colonisation initiale du site ou encore depuis la dernière perturbation majeure de l’écosystème et, en conséquence, du stade jusqu’où la végétation a pu évoluer. Quant au facteur humain (H), nul besoin de rappeler l’importance des changements que l’homme peut infliger aux écosystèmes.
Les effets de ces facteurs sur la végétation des érablières ne peuvent pas tous être présentés dans le cadre de ce seul chapitre. Ceux du climat ont déjà été illustrés par les régions écologiques (Jurdant et al., 1972; Thibault et Hotte, 1985) ou encore par les domaines ou autres grandes zones de végétation (Grandtner, 1966; Richard, 1988; Thibault et Hotte, 1985). Les trois principaux domaines de la zone feuillue sont caractérisés par des types différents d’érablières à sucre; dans la zone mixte où la végétation climacique comprend surtout des groupements de sapin et de bouleau jaune, les érablières à sucre y deviennent de plus en plus sporadiques (figure 3.1 et tableau 3.2) et globalement moins productives (Thibault et al., 1995).
Figure 3.1 Domaines de végétation comportant des érablières à sucre
Tableau 3.2 Principales entités écologiques du Québec méridional comportant des érablières à sucre avec leurs indices climatiques
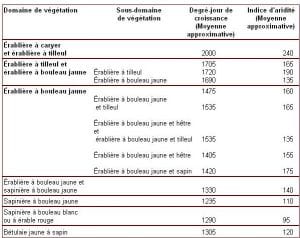
Adapté de la carte des régions écologiques de Thibault et Hotte (1985).
Les effets du relief, de la roche-mère et des eaux souterraines ne sont abordés qu’indirectement par le biais des sols (chapitre 5) et des principaux types d’érablières (chapitre 4) auxquels sont liés ces facteurs. Pour chacune des régions écologiques de la zone feuillue, Thibault et al. (1989) ont déjà schématisé l’essentiel des relations de la végétation avec ces facteurs au moyen de sères physiographiques.
3.2.2 Les facteurs secondaires du biotope
Ces facteurs sont internes et dépendants de l’écosystème. Ils résultent des influences mutuelles des composantes biotiques et abiotiques de l’écosystème, la communauté et son biotope. Ils se regroupent en quatre grandes catégories: le climat forestier, le microrelief, le sol incluant le régime des eaux souterraines et l’humus.
« Ces facteurs déterminent des relations de type corrélatif (interaction) entre deux ou plusieurs phénomènes interdépendants où la cause primaire se trouve en dehors de cette relation, mais où elle influence les composantes de cette relation. La rétroaction dans cette relation a un effet stabilisateur sur l’écosystème. Les facteurs secondaires de l’habitat appartiennent bien à l’écosystème forestier et y exercent un contrôle interne. Ce type de facteurs manque presque totalement dans les jeunes écosystèmes forestiers mais est bien développé dans les anciens systèmes.» (Fanta, 1985). Selon cet auteur, le contrôle interne dû aux facteurs secondaires l’emporterait sur le contrôle externe exercé par les facteurs primaires dans le cas des forêts naturelles les plus anciennes.
Tous ces facteurs ont évolué sous l’influence de la végétation elle-même. Ils ont pu aussi avoir été transformés par l’utilisation humaine des ressources. Par son fort pouvoir de rétention en eau, la matière organique du sol est d’autant plus importante pour la satisfaction de ce besoin par les végétaux que le dépôt meuble y est très mince ou que ses matériaux y sont très grossiers. Elle est aussi à la base de l’activité biologique et participe à la mise en disponibilité d’une part très importante des nutriments. La plus grande contribution annuelle d’éléments au pool d’éléments disponibles provient des apports biogéochimiques (chapitre 7). Quant au climat forestier ou microclimat, sous le contrôle de la végétation elle-même, il serait bien difficile de ne pas reconnaître son importance dans l’établissement de la régénération.
Tout cela démontre bien l’importance capitale des facteurs secondaires pour le développement et l’équilibre même des écosystèmes forestiers.
3.2.3 Les facteurs de croissance
Ce sont les agents du milieu, indispensables à la croissance des plantes vertes: eau, chaleur, lumière et produits chimiques du sol et de l’atmosphère. « Ils ne peuvent pas se remplacer mutuellement, tout au plus se compenser partiellement.» (Fanta, 1985). Ils exercent un contrôle externe sur le métabolisme des plantes, le contrôle interne étant d’ordre génétique.
L’offre des facteurs de croissance est réglée par les facteurs primaires et secondaires du biotope, lesquels peuvent se compenser mutuellement. Par exemple, l’offre en eau pour une certaine communauté, peut se faire aussi bien par une situation topographique favorable que par des conditions édaphiques particulières touchant à la texture ou à l’humus. Ou encore, la quantité de chaleur requise à la croissance des plantules au niveau du sol pourra être compensée, dans les régions les plus froides ou les plus humides, par de meilleures conditions micro climatiques liées à la topographie. Tout cela en vertu de la loi de constance des stations de Walter (1973 in Fanta, 1985).
L’eau et l’énergie (chaleur) disponibles en saison de croissance sont généralement évaluées au moyen d’indices climatiques tels que les degrés-jours de croissance et les bilans ou indices hydriques. Les premiers font intervenir les températures tandis que les seconds tiennent compte en outre des précipitations et des taux d’évapotranspiration potentielle et réelle, lesquels intègrent d’ailleurs une évaluation du rayonnement solaire.
Ces indices ont été estimés pour les différentes régions écologiques, sous-domaines et domaines comportant des érablières à sucre (Thibault et Hotte, 1985) (tableau 3.2). Les degrés-jours de croissance vont d’environ 2 000 pour les régions les plus chaudes comportant des érablières à caryers, à près de 1 250 pour les régions les plus froides de la zone mixte abritant encore des érablières.
Quant aux régions les plus sèches de la zone feuillue, on les observe principalement le long de la rivière des Outaouais, depuis le sud du Témiscamingue jusque vers le lac Saint-Pierre à l’est.
3.3 Quelques caractéristiques importantes de l’écosystème
Dans cette section, nous verrons quelques-unes des principales caractéristiques des écosystèmes forestiers. En premier lieu, nous traiterons d’un aspect important de la biodiversité: la richesse spécifique. Puis nous verrons la question du dynamisme ou succession écologique y compris certains des effets de la végétation sur le sol et plus particulièrement sur l’humus. Nous parlerons ensuite des notions relatives au climax et à la résilience des écosystèmes. Enfin, nous compléterons cette section en analysant le statut particulier du hêtre et sa tendance évolutive au sein des érablières à sucre.
3.3.1 Un aspect de la diversité biologique: la richesse spécifique
La diversité est inhérente aux différents niveaux d’organisation biologique (espèces, populations, communautés et écosystèmes), Parmi les communautés, par exemple, on peut parler de diversité de plantes, d’animaux ou de microorganismes. Elle réfère au nombre total d’espèces ( richesse spécifique) ou à la façon dont les individus sont distribués parmi les espèces (régularité) (Kikkawa, 1990). Nous ne parlerons ici que de la richesse spécifique.
Reiners et Lang (1979 in Lamontagne et al., 1991) ont observé que la réduction dans le nombre de niches disponibles et par conséquent dans la diversité des espèces en sols très humides était attribuable à la faiblesse du bilan calorique disponible. L’énergie disponible pour la croissance est un facteur important de la richesse floristique. Cela s’observe très bien pour les grands domaines de végétation. Par exemple, Grandtner (1966) a noté respectivement 221, 141 et 91 espèces pour les domaines des érablières à caryers et à tilleul, de l’érablière à bouleau jaune (Betula alleghaniensis Britt.) et de la sapinière.
Le statut nutritionnel d’un sol, associé dans une certaine mesure au pH de son humus, apparaît comme un autre facteur de contrôle de la richesse spécifique. En effet, pour huit types de communautés dont les stations sont réparties dans une douzaine de secteurs du sud-ouest québécois (tableau 3.3), les pH moyens de leurs humus évalués par secteur sont assez bien correlés au nombre moyen d’espèces par strate et par station. Pour la strate arborescente, les coefficients de corrélation de Pearson sont de 0,76 pour le pH moyen le plus bas contre 0,75 pour le plus élevé. Ils sont encore plus élevés pour les strates arbustives et herbacées, soit respectivement 0,87 en regard du pH moyen le plus bas contre 0,92 pour le plus élevé. La corrélation (0,74) est assez bonne aussi entre le nombre moyen d’espèces de la strate arborescente versus celui des strates arbustives et herbacées.
Tableau 3.3 Richesse spécifique des érablières de douze secteurs du sud-ouest québécois, classifiées par la méthode Braun-Blanquet et pH de l’humus
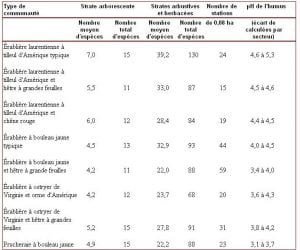
Note: Selon les données et les résultats de Majcen et al., (1984).
Parmi les huit types de communautés étudiés (sept érablières et une prucheraie), c’est celle qui a les plus fortes valeurs de pH, soit l’érablière laurentienne à tilleul d’Amérique (Tilia americana L.) typique, qui présente les plus grands nombres moyens d’espèces par station qu’elle que soit la strate et même les plus grands nombres totaux d’espèces pour le type de communauté.
De plus, en comparant les sous-associations typique et à hêtre des érablières laurentiennes à tilleul d’Amérique et à bouleau jaune pour lesquelles les différences de pH sont les plus marquées, c’est toujours la sous-association à hêtre à pH d’humus plus faible qui présente le moins d’espèces et ce, pour chaque catégorie de strates.
Pour les deux sous-associations de l’érablière à ostryer de Virginie (Ostrya virginiana (Mill.) K. Koch) qui ne se distinguent à peu près pas par le pH moyen de leurs humus, c’est très probablement le meilleur drainage et par conséquent le bilan calorique plus élevé de la sous-association à hêtre qui pourrait expliquer la plus grande richesse spécifique de ses strates.
Les perturbations constituent un autre facteur pouvant affecter la diversité. Brisson (1986) a constaté que la diversité spécifique des strates arborescentes et arbustives augmentait quelques années après perturbation pour diminuer ensuite avec l’âge de la communauté; la relation était moins évidente pour la strate herbacée. Il citait également Bormann et Likens (1979) qui ont observé un patron analogue de changement dans la diversité en milieu forestier, avec un maximum dans les premiers stades de la succession, suivie d’une décroissance après 10 ou 15 ans.
Le bilan calorique et le statut nutritionnel du sol sont certes des facteurs importants de la fertilité des stations. Aussi, pour des stades évolutifs similaires, la richesse spécifique d’une station relativement homogène devrait-elle, dans une certaine mesure, être elle-même indicatrice des niveaux de qualité ou de productivité de la station. Ayant d’ailleurs étudié l’activité biologique de six sols forestiers provenant de différents domaines de végétation du Québec méridional, Couture et Fortin (1982) ont constaté que:
« Le plus actif biologiquement était justement celui jouissant des meilleures conditions climatiques et où la végétation était la plus riche floristiquement.» C’était très certainement aussi le plus productif compte tenu du fait que «le gradient de décomposition observé entre les biotopes semblait aller de pair avec ceux observés […] au niveau des caractéristiques climatiques, phytosociologiques et pédologiques des biotopes.».
La diversité spécifique des groupes trophiques ou d’une communauté dépend principalement des espèces rares ou peu abondantes (Odum, 1971). Selon le même auteur (1976), «une diversité plus élevée […] est encore ce qu’il y a de mieux pour la performance d’un système en état de stabilité dans les cas où l’énergie ou les ressources sont modestes, c’est-à-dire complètement utilisées pour le soutien du système.».
3.3.2 Dynamisme ou succession écologique
La succession écologique peut être vue comme un mécanisme permettant de maintenir la stabilité de l’écosystème forestier (Marks, 1974 et Davis, 1981 in Sainte-Marie, 1985). Le développement de la végétation donne toujours lieu à des changements ou à des modifications dans la structure et la composition en espèces de la communauté, sa densité, etc. Ces changements finissent par altérer les conditions internes de climat forestier, de microrelief, de sol et d’humus de l’écosystème (tableau 3. 1, facteurs secondaires). Cette évolution a finalement des répercussions sur le fonctionnement même de l’écosystème: stabilité, transferts d’énergie, cycles nutritifs.
La succession secondaire fait suite à des perturbations de toutes sortes (coupes, feux, défoliations par les insectes, chablis, etc.) dans des écosystèmes déjà développés. Ces perturbations ont sûrement des rôles positifs à jouer par rapport aux écosystèmes (recyclage des nutriments, contrôle des insectes ou des maladies cryptogamiques, diversification et revitalisation de la forêt, etc.). Cependant, elles peuvent devenir néfastes pour les écosystèmes fragiles surtout si elles interviennent avec trop grande sévérité. L’érosion d’un sol très mince à la suite d’un feu qui aurait brûlé presque complètement l’humus en est un exemple.
Dans une étude des successions secondaires des forêts du haut Saint-Laurent, Bergeron et al. (1988) ont d’ailleurs démontré que «la diversité des chronoséquences successionnelles variait en fonction de l’intensité de la perturbation et de la disponibilité de la régénération locale.» Cela montre d’une part la conséquence des nouvelles conditions abiotiques créées par les perturbations, surtout au niveau des facteurs secondaires (microclimat forestier, humus, régime hydrique, sol, etc.) et, d’autre part, l’influence même de la végétation de la station et de son environnement sur la régénération.
Le travail de Brisson (1986) sur les successions secondaires des sites mésiques de l’érablière pour la MRC du haut Saint-Laurent aide à voir l’importance des conditions édaphiques, du microclimat et de la végétation originale (préalable à la perturbation) sur la nature de la succession. Les conditions édaphiques de surface et de microclimat dépendent sûrement, en très grande partie, de l’intensité même de la perturbation. Cet auteur a mis en évidence deux grands types de successions secondaires. Dans la première, les coupes à blanc favorisent le tilleul et l’ostryer qui produisent de nombreux rejets de souche, de même que le cerisier tardif (Prunus serotina Ehrh.). Dans la seconde, qui s’applique aux champs abandonnés, ce sont les espèces à grande production de graines comme le frêne blanc (Fraxinus americana L.), le bouleau gris (Betula populifolia Marsh.) et l’orme d’Amérique (Ulmus americana L.) qui contribuent d’abord à la recolonisation du site.
L’auteur ajoute: «les changements dans la dominance des espèces qui surviennent en cours de succession sont fonction de la croissance, de la survie et de la longévité différentielle des individus qui ont colonisé le milieu juste après la perturbation, situation se conformant au modèle de la “composition floristique initiale”.» Selon le même auteur, ce modèle est supporté dans plusieurs études et il est reconnu pour décrire adéquatement la succession secondaire en forêt décidue de l’est de l’Amérique du Nord.
Ainsi, le cours que prendra le développement de la végétation après la perturbation dépendra: 1- des nouvelles conditions du biotope faisant suite à la perturbation et résultant principalement des changements survenus aux facteurs secondaires; 2- de la végétation s’établissant après la perturbation, laquelle a certes un rapport avec la végétation originale (préalable à la perturbation) de la station et de son environnement. La nature et l’intensité des perturbations jouent donc un grand rôle dans les successions, sans oublier que celles-ci s’insèrent également dans le cadre des facteurs primaires.
La qualité d’une station, conditionnée par le climat et la richesse du sol, détermine non seulement son niveau de productivité mais aussi le dynamisme de la végétation. La richesse du site intervient donc nécessairement dans le dynamisme de la végétation. Par exemple, Rogers (1978 in Saucier, 1986) ainsi que ce dernier ont déjà noté pour les sites relativement riches que la régénération des feuillus, y compris celle de l’érable à sucre (Acer saccharum Marsh.), peut se faire aux dépens d’une espèce moins exigeante comme la pruche (Tsuga canadensis (L.) Carr.), après l’ouverture du couvert.
La prévision du dynamisme de la végétation nécessite non seulement des connaissances sur l’autécologie des espèces, leurs rapports avec le climat et les sols, mais aussi sur la phytosociologie. La structure verticale de la végétation et principalement la composition des strates arbustives hautes et intermédiaires aident souvent à prévoir les futurs stades de la végétation.
Les principales espèces compétitrices de l’érable à sucre à l’échelle du Québec sont regroupées au tableau 3.4 par grande classe de tolérance à l’ombre ainsi que par grand domaine de végétation. Elles sont présentées selon leur fréquence relative à dominer le couvert sur les sites des érablières à sucre. Les résultats donnent une idée des principaux types de couverts ou de groupements possibles à différents stades évolutifs, dans l’ensemble du domaine. Par rapport à ce classement, l’érable à sucre se situe dans la catégorie des espèces très tolérantes. Il forme donc des groupements relativement stables ou climaciques, composés non seulement d’espèces très tolérantes mais aussi de tolérance intermédiaire.
Tableau 3.4 Principales espèces arborescentes ou arbustives compétitrices de l’érable à sucre1. par grand domaine de végétation2. et grande classe de tolérance des espèces
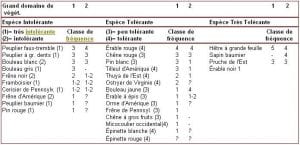
? Espèce incertaine, si applicable, n’occupe ou ne domine sûrement qu’une infime proportion des sites
1. Les resultats proviennent de Thibault et ai. (1989) et ont ete ajustes pour tenir compte de ceux Thibault et Tremblay (1994). Ils representent les especes dominantes du couvert des placettes ou micro-placettes ayant ete associees aux sites des erablieres a sucre en considerant principalement leur composition floristique y compris les caracteristiques majeures (region, drainage, depot, situation topographique, sol, huus, etc.) du biotope. Certaines communautes peuvent resulter directement de l’activite humaine, surtout celles dominees par les pins et les epinettes. Celles des especes arbustives ou autres non-commerciales, comme le cerisier de Pennsylvanie, sont surement sous-representees.
2. Le grand domaine #1 regroupe les domaines comprenant des erablieres a caryers et a filleul (regions ecologiques 1 et 2 de Thibault et Hotte. 1985); le grand domaine #2, les domaines de l’erabliere a bouleau jaune, de la sapiniere a bouleau jaune, a erable rouge et de la betulaie a bouleau jaune et sapin (regions ecologiques 3 a 7) (figure 3.1).
intolerante: La classe est adaptee de Belanger (1972) ainsi que de Bums Honkala (1990).
frequence: Classe pour frequence relative approximative:
1: < 5% 2:5-9% 3:10-29% 4:30-59% 5:>=60%
Les espèces intolérantes dominant le plus souvent les sites des érablières à sucre en début de succession sont les peupliers faux-tremble (Populus tremuloides Michx.) et à grandes dents (P. grandidentata Michx.), les bouleaux blanc (Betula papyrifolia Marsh.) et gris (B. populifolia Marsh.), le frêne noir (Fraxinus nigra Marsh.), le cerisier de Pennsylvanie (Prunus pensylvanica L. f.) et les framboisiers (Rubus sp.). Les principales espèces tolérantes et compétitrices de l’érable à sucre sont l’érable rouge (Acer rubrum L.), le chêne rouge (Quercus rubra L.), le bouleau jaune généralement associé à l’érable à épis (Acer spicatum Lam.), le pin blanc (Pinus strobus L.), le tilleul, le thuya (Thuja occidentalis L.) et l’ostryer de Virginie (Ostrya virginiana (Mill.) K. Koch).
Dans la troisième catégorie, soit celle des espèces très tolérantes, il n’y a que le hêtre à grandes feuilles et, à un degré moindre, la pruche et le sapin baumier qui soient importants comme compétiteurs. Ils forment nécessairement avec l’érable à sucre des groupements très stables de fin de succession.
«Les feuillus tels que l’érable rouge, le chêne rouge et le hêtre à grandes feuilles colonisent généralement des sols podzoliques.» (Burns et Honkala, 1990).
Il en est de même et à plus forte raison pour la pruche, le sapin et autres résineux, surtout s’ils sont présents naturellement, en quantité et depuis longtemps sur le site. C’est aussi le cas pour le bouleau jaune et l’érable à épis sous nos climats. (Thibault et al., 1989).
Aussi, à cause des effets acidifiants des résineux sur le sol, les stations en comportant de fortes proportions ne pourront pas toujours, sinon, difficilement, évoluer vers des érablières à sucre, à moins que des perturbations ou certains aménagements ne viennent améliorer substantiellement les conditions physiques ou nutritionnelles de leur site et principalement par le biais des facteurs secondaires.
D’autre part, les espèces plus exigeantes comme les caryers cordiforme (Carya cordiformis (Wang.)) et ovata (C. ovata (Mill.) K. Koch), l’érable noir (Acer nigrum Michx. f.), le noyer cendré (Juglans cinerea L.), le frêne d’Amérique, les ormes d’Amérique et de Thomas (Ulmus thomasii Sarg.), le tilleul et l’ostryer de Virginie, etc. sont plus souvent associées aux sols brunisoliques que ne le sont les espèces précédentes et les résineux, selon les résultats de Thibault et al. (1989). De plus, ces sols sont surtout abondants dans les régions méridionales de la zone feuillue où se confinent presque exclusivement ces espèces (figure 3.1).
La plupart de ces espèces devraient être très bénéfiques pour la conservation de la fertilité du sol et l’équilibre même de leurs communautés. En effet, Burns et Honkala (1990) soulignent les apports importants de minéraux au sol et à la végétation du sous-bois par le feuillage de l’ostryer de Virginie, du tilleul et de l’orme d’Amérique. Quant aux caryers et à l’érable noir, on connaît bien leur préférence pour les sols de calcaires ou de dolomites notamment; d’autre part, le noyer cendré, le frêne d’Amérique et les ormes affectionnent souvent les sols brunisoliques riches et profonds. Le recyclage des nutriments par la litière de ces espèces doit être d’autant plus important pour le maintien de la fertilité du site qu’elles sont déjà peu abondantes dans le milieu.
De plus, les régions à plus fortes concentrations de sols brunisoliques et où croissent presqu’exclusivement les espèces dites exigeantes (domaines des érablières à caryers, à tilleul ainsi qu’à bouleau jaune et tilleul), présentent toutes de meilleurs indices de croissance pour l’érable à sucre (stations mésiques et submésiques) que celles essentiellement dépourvues de ces espèces (Thibault et al., 1995).
3.3.3 Quelques changements au sol et particulièrement sur l’humus en cours de succession
Les effets des litières de résineux (pins, pruches et épinettes) sur le sol ont déjà été démontrés et discutés. Kimmins (1987) souligne les travaux d’Olson (1958) sur les effets à long terme de la végétation sur les conditions physiques des dunes de sable du lac Michigan. Sur près de 10 000 ans, la végétation qui a notamment connu des stades de pins et de sapins, a fait passer le pH de la surface du sol de 7,7 à 4,0. Un horizon éluvial cendré d’un pH d’environ 4,5 et caractéristique des sols podzoliques se serait formé après environ 1 000 ans. Certains climax comprennent aujourd’hui des forêts d’érable à sucre et de hêtre.
La pruche et le hêtre sont également connus pour leurs litières acidifiantes qui favorisent le lessivage ou podzolisation des sols. Citant Nicholson et al. (1979) et Woods (1984), Saucier (1986) rapporte que «la pruche modifie énormément l’environnement des peuplements qu’elle domine en créant un sous-bois sombre et une litière très dense et très acide […] à un point tel que les autres espèces ne peuvent se développer que lorsque des ouvertures se créent dans le couvert ou dans la litière.»
Bouliane (1962) a déjà attribué l’expansion du hêtre à un aménagement non approprié des érablières tandis que pour Grandtner (1966) et Rushmore (1961 in Sainte-Marie, 1985), c’est une certaine acidification de la litière, accélérée par le hêtre lui-même à la suite de la coupe des érables, qui peut favoriser cette espèce.
Les résultats de Majcen et al., (1984) sont également très probants quant aux effets du hêtre et de la pruche sur l’acidification de l’humus ( tableau 3.3). Dans les érablières à bouleau jaune et laurentienne à tilleul d’Amérique, les valeurs maximales des moyennes de pH des humus, calculées par secteur, sont nettement plus basses pour les sous-associations à hêtre que pour les typiques: 4,0 contre 4,5 dans le cas de l’érablière à bouleau jaune et 4,6 contre 5,3 pour l’érablière laurentienne à tilleul d’Amérique. La différence ne semble pas significative dans le cas de l’érablière à ostryer: 4,2 pour la sous-association à hêtre contre 4,3 pour celle à orme d’Amérique.
Les pH les plus élevés sont ceux de l’érablière laurentienne à tilleul (4,4 à 5,3); les plus bas, ceux de la prucheraie à bouleau jaune (3,1 à 3,7). Ceux des érablières à bouleau jaune et à ostryer de Virginie ont des valeurs intermédiaires entre ces extrêmes (3,4 à 4,5). Or, l’érablière à tilleul se distingue des autres érablières par la présence quasi exclusive du frêne d’Amérique, une espèce très exigeante quant à la qualité du sol; aussi, le tilleul y est-il plus important que dans l’érablière à ostryer alors qu’il est très sporadique dans celle à bouleau jaune. Ces espèces jouent sûrement un rôle majeur dans le maintien des propriétés et des qualités de l’humus. Nous avons déjà souligné les apports importants de minéraux par la litière de quelques espèces exigeantes dont le tilleul (Burns et Honkala, 1990). Le frêne d’Amérique y recycle très sûrement aussi d’importantes quantités de minéraux.
Par contre, dans le cas de la prucheraie à bouleau jaune, les moyennes minimales et maximales ( 3,1 à 3,7) sont toujours inférieures aux valeurs atteintes pour les différents types d’érablières. Les plus basses moyennes minimales et maximales pour ces dernières sont celles des érablières à bouleau jaune et hêtre (3,4 à 4,0 ) (tableau 3.3). L’effet acidifiant de la pruche semble plus marqué que celui du hêtre.
3.3.4 Notions de climax
Delpech et al. (1985) définissent ainsi le climax: «État d’un écosystème ayant atteint un stade d’équilibre relativement stable (du moins à l’échelle humaine), conditionné par les seuls facteurs climatiques et édaphiques.>>. «La principale caractéristique de la communauté climacique, c’est sa capacité de se perpétuer en l’absence de perturbations sévères.» (Lorimer, 1977 et 1980 in Sainte-Marie, 1985).
L’étude démographique et écologique de Sainte-Marie (1985) sur des érablières composées principalement d’érable à sucre, de hêtre et de bouleau jaune révèle la complexité des mécanismes de maintien d’un climax. L’auteur affirme notamment: «nous pouvons déceler l’existence d’un cycle de maintien de l’érable à sucre [ …] l’alternance spatio- temporelle des trois espèces, fait des communautés étudiées des forêts climaciques dont la permanence est due à une stabilité dynamique et non statique.».
En pareil cas, les communautés, tantôt à dominance de hêtre, tantôt à dominance d’érable à sucre, appartiendraient à un même ensemble de végétation climacique. Cela nous éloigne quelque peu de la perception traditionnelle d’un climax unique.
L’érable à sucre est reconnu pour sa très grande tolérance à l’ombre comme le sont d’ailleurs le hêtre à grandes feuilles (Fagus grandifiblia Ehrh.), la pruche, le sapin, l’érable noir et le charme de Caroline (Carpinus caroliniana Walt.); ces deux dernières espèces, essentiellement confinées au domaine comprenant des érablières à caryers, sont peu importantes dans l’ensemble des érablières. L’érable à sucre forme des communautés relativement stables ou climaciques, principalement composées d’espèces tolérantes ou très tolérantes (tableau 3.4). Ce sont entre autres les érablières laurentienne à tilleul, à bouleau jaune, à hêtre à grandes feuilles, à pruche, à ostryer de Virginie, etc.
Pour mieux saisir la notion de climax, examinons le climax régional le plus méridional du Québec dont l’appellation de l’érablière à caryers (Grandtner, 1966) a déjà été remise en cause (Brisson et aL 1988a, 1992). Cela, à la suite de la découverte dans la forêt de Muir de la MRC du haut Saint-Laurent, d’une érablière à hêtre très âgée sur site mésique et sol brunisolique.
Également, Doyon (1991) qui a étudié le statut successionnel des espèces de l’érablière pour les sites mésiques de la même MRC, en est venu à proposer le remplacement de l’appellation du climax régional de l’érablière à caryers par celle de l’érablière à hêtre et pruche. Dans son étude, le statut successionnel des espèces a été établi en confrontant leur abondance au taux d’accumulation de biomasse (biomasse/ productivité primaire nette). L’auteur cite d’ailleurs Whittaker et Woodwell (1972) selon lesquels le rapport B/PPN est la variable qui rend le mieux compte de l’évolution temporelle des communautés, de même que Whittaker et Woodwell (1968) selon lesquels les plus vieilles forêts de la forêt décidue nordique semblent avoir atteint l’état d’équilibre lorsque leur rapport B/PPN varie entre 40 et 50. «Parmi les grands arbres feuillus, seul le hêtre à grandes feuilles est aussi tolérant que l’érable à sucre.» (Godman, 1965, in Burns et Honkala, 1990).
Dans les régions les plus méridionales de la zone feuillue (domaines incluant les érablières à caryers, laurentiennes à tilleul et à bouleau jaune et tilleul), la seule autre espèce très tolérante qui s’associe couramment à ces dernières et qui parvient à dominer le couvert est la pruche.
Or, nous avons déjà amplement parlé des affinités du hêtre, de la pruche et autres résineux pour les sols podzoliques. L’érablière à hêtre (et pruche) est certes un groupement en toute fin de succession qui colonise surtout ce genre de sols développés sur des sites relativement mésiques dans les régions méridionales de la zone de l’érablière. Dans les domaines comportant des érablières à caryers ou à tilleul (figure 3-1), la végétation climacique des sites mésiques correspond surtout à des sols brunisoliques si l’on en juge par les compilations de Thibault et al (1989) pour l’ensemble de la zone feuillue ou même par le travail de Meilleur (1986) dans la MRC du haut Saint-Laurent.
Celle de Meilleur (1986) pour le seul secteur Cazaville de la MRC du haut Saint-Laurent donne un aperçu des principales relations des groupements forestiers avec les grands types de sols et leurs propriétés. Cet auteur a reconnu 13 types écologiques (sensu? Jurdant et al., 1977, les sols d’un même type y étant parfois très variables), chacun identifié par un stade de végétation dit “mature”. Nous n’avons considéré que les types les plus près des conditions mésiques, c’est-à-dire de drainage bon à imparfait tout en excluant cependant celui de la prucheraie du Canada à pin blanc sur roche-mère nettement sableuse. Les quatre types finalement retenus sont les suivants: 1 – l’érablière à sucre à caryer cordiforme et à frêne américain; 2- l’érablière à sucre à caryer cordiforme et à tilleul américain; 3- l’érablière à sucre à tilleul américain et à hêtre à grandes feuilles; 4- l’érablière à sucre à pruche du Canada. Les variables abiotiques les plus importantes de ces types comprennent notamment la pierrosité, la granulométrie, le drainage, les pH et le contenu en azote de l’horizon Ah. Ces variables sont toutes plus ou moins indicatrices de la qualité des sols.
Voyons ce qui ressort de ces résultats. Sauf pour une station sur sol podzolique, celles des types des érablières à caryers sont toutes caractérisées par des sols brunisoliques dont les pH des horizons A ou B sont relativement élevés. Ces types correspondent de toute évidence aux sols les plus riches. Pour celui de l’érablière à caryer cordiforme et à tilleul, les sols observés sont tous des brunisols mélaniques; or, ce type de sol est celui possédant les meilleures propriétés parmi les quatre grands groupes que compte l’ordre brunisolique dans la classification canadienne des sols (CCP, 1978). Quant à l’érablière à sucre à pruche du Canada, elle correspond visiblement au type écologique le plus pauvre, dont les sols très variables regroupent les phases pierreuses à matrice plus sablonneuse. Enfin, le type de l’érablière à tilleul américain et à hêtre à grandes feuilles présente des conditions physico-chimiques ou de fertilité qui semblent nettement intermédiaires par rapport à celles des érablières à caryer cordiforme et de l’érablière à pruche. Bien que très variables, ces sols appartiennent surtout à l’ordre brunisolique et ne sont en général ni les plus riches, ni les plus pauvres.
L’étude de Saint-Jacques (1986) pour le secteur nord-ouest de la vallée du Saint-Laurent, associe les érablières à hêtre et les érablières à tilleul d’Amérique à des sols bien à modérément drainés et légèrement acides, les secondes se distinguant des premières par une rocaillosité généralement plus élevée, une plus grande richesse moyenne des horizons supérieurs du sol en éléments minéraux, de même que par un sol pouvant être plus frais. Il les considère toutes deux comme étant probablement stables ou climaciques. Des variations qui peuvent sembler bien minimes dans les propriétés des sols se traduisent parfois par des communautés différentes, climaciques ou non.
Ce type d’érablière à tilleul (et hêtre) sur sol brunisolique semble très représentatif du climax régional en équilibre avec le climat pour les régions les plus chaudes du Québec, même si le tilleul est moins tolérant que le hêtre. Sa relative permanence ou durabilité comme écosystème pourrait très bien alors dépendre des perturbations légères survenant épisodiquement dans le milieu et même de la sauvegarde des espèces les plus exigeantes sur le site, de sorte que l’effet à long terme d’appauvrissement du sol par le hêtre et les autres espèces acidophiles ne finisse pas par devenir prépondérant.
Dans les mêmes régions, l’ostryer de Virginie, une espèce moins tolérante mais plus exigeante que le hêtre quant à la qualité du sol, s’associe assez souvent à l’érable à sucre et au hêtre à grandes feuilles sur des sites mésiques ou proches de ces conditions (tableau 3.4). Plusieurs auteurs considèrent que cette espèce forme, avec l’érable à sucre, des communautés relativement stables ou climaciques (Doyon, 1975; Brown, 1981; Majcen et al., 1984). Leurs sites sont généralement mieux drainés que ceux de l’érablière à tilleul.
Ces quelques résultats démontrent assez bien jusqu’à quel point la variabilité des conditions de sol détermine le ou les types de végétation ou de groupements relativement stables apparaissant sur des sites plus ou moins mésiques en fin de succession. Il en est de même pour les sites xériques et hydriques.
3.3.5 Notions de résilience
«La résilience ou stabilité d’inertie est le degré de résistance de l’écosystème au changement. Les écosystèmes des sites mésiques ont une plus grande résilience que ceux des sites xériques ou hydriques.» (Kimmins, 1987).
Donc, d’une façon générale, ce sont les communautés des sites les plus productifs qui devraient avoir les plus forts taux de résilience et résister le mieux aux changements ou aux stress d’ordre physiologique liés à l’habitat ou à la pollution. Cela a déjà été observé dans le cas du phénomène du dépérissement. En effet, selon Roy et Gagnon (1991), « ce sont les habitats secs et, à l’opposé, les habitats humides qui ont été les premiers à dépérir.».
Sainte-Marie (1985) attribue la permanence de l’érable à sucre à sa grande tolérance à l’ombre à toutes les étapes de sa maturité ainsi qu’à son opportunisme face aux petites éclaircies, sans oublier sa production très forte et régulière de jeunes pousses. Sa vigueur et sa capacité à maintenir sa dominance sont d’autant plus grandes que les conditions abiotiques ou de l’habitat y sont plus favorables. Cela se voit généralement par l’importance et la vigueur affichées par l’espèce dans les strates intermédiaires. Certains travaux confirment la place privilégiée de l’érable à sucre de même que sa forte propension (résilience) à retrouver celle qu’il pouvait occuper autrefois dans les forêts de la zone feuillue.
Dans son étude des sites mésiques de la MRC du haut Saint-Laurent où la végétation d’un seul site semblait se diriger vers une communauté à dominance de hêtre, Brisson (1986) n’en conclut pas moins: «Rien ne nous permet de croire que les autres érablières échantillonnées évolueront à court terme vers un autre type de communauté.» Un constat similaire a également été fait par Saucier (1986) pour la plupart des sites mésiques étudiés dans le même secteur: «Acer saccharum constitue la principale espèce climacique de ce type de milieu.».
Par contre, sur certains sites ne comptant peut-être pas parmi les plus productifs pour l’érable à sucre et où cette espèce se trouve en compétition avec une autre espèce aussi tolérante comme le hêtre, ces deux espèces peuvent alterner l’une et l’autre sur un même site pour la dominance du couvert. Une forte abondance du hêtre dans la communauté peut souvent signifier un sol quelque peu limitatif au plan nutritif. Compte tenu également des propriétés mêmes de la litière du hêtre, tout cela peut se traduire par une moins bonne résilience de l’érable à sucre sur de tels sites.
Une autre notion de la stabilité est celle de l’élasticité que Kimmins (1987) définit comme: «La vitesse avec laquelle un écosystème perturbé revient à sa condition initiale.».
Elle sera d’autant plus faible que le biotope (notamment le sol ou l’humus) aura été plus profondément modifié et que les nouvelles espèces (notamment les espèces pionnières) à s’installer en début de succession seront très longévives.
Considérant la notion de résilience au sens de Leps et al. 0 982 in Bergeron et al., 1988), soit la rapidité avec laquelle la communauté revient à sa situation d’origine, Bergeron et al. (1988) ont démontré l’importance de l’environnement forestier sur la longueur des successions pour les forêts feuillues de la MRC du haut Saint-Laurent. Ils écrivent: «En milieu à dominance forestière, là où la présence d’espèces comme Tsuga canadensis ou Acer saccharum est élevée, les communautés montrent une résilience rapide […]. À l’opposé, en milieu plus morcelé, où la présence des espèces de fin de succession est plus faible et où les perturbations sont plus intenses et de plus grandes superficies, on assiste à des successions beaucoup plus longues.».
3.3.6 Statut et tendance évolutive du hêtre à grandes feuilles
Étant donné la présence de cette espèce dans plusieurs types d’érablières climaciques et la problématique déjà maintes fois soulevées, notamment en ce qui concerne les causes, les conséquences ou le rythme de son expansion, il peut être intéressant de voir son statut actuel et la tendance réelle de son évolution au sein des érablières.
A cet effet, nous avons analysé les relevés de végétation de trois études réalisées dans des régions assez représentatives des zones feuillue et mixte: le sud-ouest du Québec, la Mauricie et le Bas-Saint-Laurent. Ces relevés appartiennent uniquement aux sous-associations à hêtre des érablières à tilleul, à ostryer et à bouleau jaune ou encore à l’association de l’érablière à hêtre. Ils ont tous été réalisés selon la méthode de Braun-Blanquet. Le tableau 3.5 donne un aperçu du pourcentage de relevés des érablières où le hêtre surpasse l’érable à sucre en abondance – dominance dans les strates arborées et arbustives hautes.
Tableau 3.5 Pourcentage des relevés des érablières à sucre où le hêtre domine sur l’érable à sucre dans les strates arborées et arbustives hautes
Dans les strates arborées des érablières à sucre où le hêtre est relativement important, cette espèce ne domine l’érable à sucre que dans 3,5 % des 169 stations étudiées. Par contre, cette dominance atteint 10,6 % dans la strate arbustive haute du sous-bois.
Ce regain du hêtre n’est peut-être pas étranger aux coupes sélectives importantes de feuillus nobles tels le bouleau jaune, le caryer, le frêne d’Amérique, le tilleul, l’orme, etc. qui ont été pratiquées dans le passé. Gagnerait-il du terrain sur ces espèces et même sur l’érable à sucre ou ne ferait-il que retrouver la place qu’il occupait jadis? Brisson et al. (1992) croient que le hêtre a déjà été une composante plus importante des forêts feuillues mûres du sud du Québec.
L’érable à sucre maintien donc sa dominance dans la strate arbustive haute dans près de 90 % des stations des principales associations ou sous-associations à hêtre. Il ne paraît donc nullement menacé par cette espèce à moyen terme. Selon Brisson et al. (1988), qui ont étudié la dynamique forestière des érablières laurentiennes du mont Saint-Bruno, la mauvaise dispersion du hêtre résulte de son mode de distribution qu’ils qualifient de contagieuse. Le poids relativement élevé de ses fruits contribue sûrement à en limiter la propagation.
La proportion du hêtre dans les strates arbustives est beaucoup plus forte dans le comté de l’Islet que dans les douze secteurs du sud-ouest québécois (22,7 contre 6,6 %). C’est aussi dans ce comté que le regain semble être le plus fort. Faut-il y voir là une autre cause que celle d’une simple recrudescence naturelle de l’espèce suite à son exploitation dans le passé?
3.4 Conclusion
Les résultats font ressortir la complexité et l’importance de la dimension fonctionnelle de l’écosystème, l’ensemble des facteurs contrôlant son développement ainsi que la signification et la portée de quelques-unes des principales caractéristiques mêmes de l’écosystème. L’équation fondamentale sur le fonctionnement de l’écosystème s’avère certes très utile pour la perception des principaux facteurs primaires déterminant l’écosystème. Elle ne permet pas cependant de réaliser toute la place et l’importance que peuvent avoir les facteurs secondaires face au maintien et à l’équilibre des écosystèmes dont le développement est avancé.
Le tableau de Fanta (1985), qui présente l’ensemble des facteurs en cause dans le développement de l’écosystème, montre justement à quel niveau agissent chacun des types de facteurs en plus de renseigner sur la nature et le sens de leurs liens (liens causaux ou de type corrélatif) par rapport à la végétation. Il favorise donc une perception très globale de l’écosystème forestier.
Les facteurs de croissance qui agissent directement sur la végétation sont contrôlés par les facteurs primaires et secondaires du biotope. L’importance des facteurs secondaires pour l’écosystème est mise en évidence lorsque sont abordées la question de la nutrition de la végétation sur une base annuelle (cycles biogéochimiques), la satisfaction des besoins en eau de certaines stations, la richesse spécifique des communautés selon le niveau de pH des humus, ou encore lorsque l’on envisage les caractéristiques ou les processus importants de l’écosystème tels que la succession écologique (nature de la régénération et durée des successions), la nature du climax (compte tenu des préférences des espèces et des communautés pour les grands types de sols et leur niveau de fertilité), les notions de résilience et même, dans une certaine mesure, la productivité des stations.
Comme le dit si bien Fanta (1985), «le contrôle interne dû aux facteurs secondaires l’emporterait sur le contrôle externe exercé par les facteurs primaires dans le cas des forêts naturelles les plus anciennes.».
La plupart de nos observations tendent d’ailleurs à confirmer le bien fondé de ce postulat.
Bibliograiphie
Bélanger, M., 1972. La tolérance des arbres à l’ombre. Forêt Conservation, 38 (5): 15-16. Bergeron, Y., A. Bouchard et A. Leduc, 1988. Les successions secondaires dans les forêts du Haut-Saint-Laurent, Québec. Naturaliste can. 115: 19-38.
Bouliane, A., 1962. Étude de la transformation de l’érablière à sucre en hêtraie. Fac. for. et géod., Univ. Laval, Québec, 72 p.
Brisson, J., 1986. Successions forestières sur sites mésiques dans la MRC du Haut-Saint-Laurent. Thèse M. Sc., Univ. de Montréal, 62 p.
Brisson, J., Y. Bergeron et A. Bouchard, 1988. Les successions secondaires sur sites mésiques dans le Haut-Saint- Laurent, Québec. Can. J. Bot. 66 (6): 1192-1203.
Brisson, J., Y. Bergeron et A. Bouchard, 1992. The history and tree stratum of an old-growth forest of Haut-Saint- Laurent region, Quebec. Natural Areas jour. 12 (1): 3-9
Brisson, J., D. Gagnon et Y. Bergeron, 1988. Dynamique forestière des érablières laurentiennes du mont Saint- Bruno: la relation entre le hêtre à grandes feuilles et l’érable à sucre. Groupe de rech. écol. for., Dépt. des sci. biol., Univ. du Québec à Montréal, Montréal. Rap. rech. n° 7.
Brown, J.-L., 1981. Les forêts du Témiscamingue Québec, écologie et photo-interprétation. Lab. Écol. for., Univ. Laval, Québec. Études écologiques n° 5, 447 p.
Burns, R. M. and B. H. Honkala, 1990. Silvics of North America. Vol. 2, Hardwoods. Forest Service, USDA, Washington. Agriculture handbook 654, 877p.
CCP, 1978. Le système canadien de classification des sols. Dir. rech., Min. Agric. Canada, 170 p.
Couture, C. et J. A. Fortin, 1982. Activité biologique dans les sols de six écosystèmes forestiers du Québec méridional. Revue can. science du sol, 62: 599-615.
Delpech, R., G. Dumé et P. Galmiche, 1985. Typologie des stations forestières: Vocabulaire. Min. Agric., Dir. For., Institut pour le développement forestier, Paris, 243 p.
Doyon, D., 1975. Étude éco-dynamique de la végétation du comté de Lévis. Serv. déf. cult., Min. Agric., Québec. Mém. n° 1.
Doyon, F., 1991. Productivité et dynamisme des communautés forestières sur sites mésiques dans le Haut-Saint- Laurent, Québec. Thèse M.Sc., Univ. de Montréal, Montréal, Québec, 95 p.
Fanta, J., 1985. Forest site: research, classification and application to forestry. Nederlands Bosbouwtijdschrift, 57: 333-347.
Gérardin, V., 1989. Introduction à l’écologie forestière. OIFQ, L’Aubelle, 73, 14 p.
Grandtner, m. m., 1966. La végétation forestière du Québec méridional. Les Presses de l’Univ. Laval, Québec, 216 p.
Jean, R., 1982. Les érablières sucrières du comté de l’Islet. Étude phyto-écologique. Lab. écol. for., Univ. Laval, Québec. Études écologiques, 7.
Jenny, H.,1980. The soil ressource. Origin and behaviour. Springer, New York, 337 p.
Jurdant, M.J. Beaubien,J.-L. Béair,J.-C. Dionne et V. Gérardin, 1972. Carte écologique de la région du Saguenay-Lac- Jean. Notice explicative. Vol. 1: l’environnement et ses ressources; identification, analyse et évaluation. Centre de rech. for. des Laurentides, Env. Canada, Québec. Rap. d’inf. Q-F-X-31, 93 p.
Jurdant,M.,J.-L. Bélair, V. Gérardin etJ.-P. Ducruc, 1977. L’inventaire du Capital-Nature. Méthode de classification et de cartographie du territoire (3ème approximation). Serv. des études écol. régionales, Dir. région. des terres, Pêches et Env. Canada, Québec. 202 p.
Kikkawa, J., 1990. Biological diversity of tropical forest ecosystems. Dans: Rapport sur le Congrès, vol B, IUFRO, = Congrès mondial, Montréal, Canada, 173-184.
Kimmins, J. P., 1987. Forest Ecology. MacMillan Publishing Company, New York and Collier MacMillan Publishers, London, 531 p.
Lalumière, R. et M. Thibault, 1988. Les forêts du parc national de la Mauricie au Québec. Presses de l’Univ. Laval, Québec. Études écologiques, 11.
Lamontagne, L., C. Camiré et C. Ansseau, 1991. La végétation forestière du delta de Lanoraie, Québec. Can. J. Bot., 69 (8): 1839-1852.
Majcen, Z., Y. Richard et M. Ménard, 1984. Écologie et dendrométrie dans le sud-ouest du Québec. Étude de douze secteurs forestiers. Serv. rech., MER, Québec, Mém. n° 85, 333 P.
Meilleur, A., 1986. Étude des communautés végétales du secteur Cazaville de la MRC du Haut-Saint-Laurent, Québec. Thèse M. Sc., Univ. de Montréal, 116 p.+ annexes.
Odum, E. P., 1971. Fundamentals of Ecology. Third edition. W. B. Saunders Company, Toronto, 574 p.
Odum, E. P., 1976. Écologie. Les éditions HRW Ltée, Montréal, 254 p.
Richard, P.J. H., 1988. Végétation du Québec-Labrador. Formations et grands domaines. Départ. géogr., Univ. Montréal. Carte couleur à 1: 5 000 000.
Roy, G. et G. Gagnon, 1991. Application de la phytosociologie à l’étude de l’évolution et du mécanisme du dépérissement des érablières dans le sud du Québec. Dir. rech., Min. For., Mém. n° 102.
Sainte-Marie, A., 1985. Analyse démographique et écologique de quelques espèces d’arbres du Québec méridional. Thèse M. Sc., Univ. de Montréal, 159 p.
Saint-Jacques, C., 1986. La végétation forestière du secteur nord-ouest de la vallée du SaintLaurent, Québec. Thèse M. Sc., UQAM, Montréal.
Saucier, I., 1986. La végétation forestière du secteur d’Huntingdon, MRC du Haut-Saint-Laurent, Québec. Thèse M. Sc., Univ. de Montréal, 118 p. + annexes.
Thibault, M. et D. Hotte, 1985. Les régions écologiques du Québec méridional, (2éme approximation). Serv. rech. et Serv. cartogr., MER, Québec. Carte 1:1 250 000.
Thibault, M., D. Hotte et M. Tanguay, 1994. Les régions de croissance du Québec méridional. Dir. rech., MER, Québec. Mém. à paraître.
Thibault, M., L. Carrier, D. Hotte et M. Gagnon, 1989. Végétation et facteurs du milieu dans les régions écologiques du Québec méridional. Première partie: la zone feuillue. Serv. rech. appl., Dir. rech. et dév., MER, Rap. int. n° 313, 2 tomes, 391 p.
Thibault, M. et M. J. H. Tremblay, 1994. Types forestiers, groupes évolutifs et strates cartographiques du Québec méridional. Serv. rech. appl., Dir. rech., Min. Ress. Nat. Rap. interne à paraître.
4 Écosystèmes d’érablière
Gabriel Roy, Gilles Gagnon, Colette Ansseau avec la collaboration de Maurice Gagnon et Jean-Marc Boivin
4.1 Niveaux de perception de la classification
La classification est un processus naturel pour l’homme et lui permet d’améliorer la compréhension des mécanismes naturels de son environnement. Avec l’augmentation des problèmes environnementaux comme les polluants atmosphériques ou l’effet de serre et la pression de l’industrie acéricole et forestière exercée sur l’érablière, il devient de plus en plus important d’adapter les principes d’aménagement aux particularités écologiques des divers types d’érablières. Dans ce contexte, une classification des érablières aide l’aménagiste et favorise l’aménagement intégré.
Comme il est précisé dans la section «notions d’écosystèmes», présentée précédemment, il existe plusieurs méthodes pour classifier la végétation. Cependant, au Québec, deux approches sont particulièrement utilisées par les écologistes: la première utilise la notion des types écologiques basée sur les facteurs stables de l’environnement; la seconde utilise l’abondance-dominance de certaines espèces arborées et contient des espèces dites caractéristiques, qui sont, même avec une abondance faible, spécifiques à un habitat donné.
Dans le cadre de ce travail, nous avons rassemblé et consulté un grand nombre de descriptions écologiques d’érablières. Ces descriptions phytosociologiques utilisent principalement la nomenclature des associations végétales. La même nomenclature a été utilisée dans le présent travail.
La première étape a consisté à rassembler toutes les descriptions selon l’association, puis la sous-association. Cette étape permet d’actualiser les anciennes nomenclatures, de rassembler les érablières par leurs affinités écologiques et d’établir une liste des érablières les plus représentatives des forêts feuillues du Québec. Tous les critères écologiques qui permettent d’identifier une érablière ont été synthétisés et rassemblés sous forme de tableaux. Cette présentation facilite le travail du praticien forestier dans sa recherche d’informations pertinentes sur l’identification et la description des érablières. Aux caractères écologiques des érablières, on a ajouté des informations sur les successions végétales après perturbation et sur la productivité, lorsqu’elles étaient disponibles. La productivité rassemble des données dendrométriques basées sur la médiane, moins sensible aux valeurs extrêmes. Dans un contexte aussi large, des données doivent s’interpréter comme un aperçu des conditions naturelles. La productivité est calculée afin d’établir une base de comparaison entre les différents groupements plutôt que de refléter les conditions de terrain. La distribution géographique des érablières provient de la carte des régions écologiques du Québec méridional, de Thibault (1985).
Thibault, M., 1985. Les regions ecologiques du Quebec meridional (carte). Min. Ener. et Ress., Quebec.
Le recensement de toutes les érablières décrites permet de reconnaître et de rassembler les différents types d’érablières au Québec méridional. L’inventaire regroupe des érablières à érable à sucre (Acer saccharum Marsh.), à érable noir (Acer nigrum Michx. f.), à érable rouge (Acer rubrum L.) et à érable argenté (Acer saccharinum L.). Par convention, l’expression «érablières», employée seule désigne les peuplements d’érable à sucre; dans tous les autres cas, il devient nécessaire de préciser l’espèce d’érable dominant comme l’érablière noire, l’érablière rouge ou l’érablière argentée.
Les différents types d’érablières décrits sont
• Érablière noire à caryer cordiforme
• Érablière à caryer cordiforme
• Érablière à tilleul d’Amérique typique
• Érablière à tilleul d’Amérique et chêne rouge
• Érablière à tilleul d’Amérique et hêtre à grandes feuilles
• Érablière à tilleul d’Amérique et orme d’Amérique
• Érablière à tilleul d’Amérique et noyer cendré
• Érablière à ostryer de Virginie typique
• Érablière à ostryer de Virginie et chêne rouge
• Érablière à ostryer de Virginie et hêtre à grandes feuilles
• Érablière à ostryer de Virginie et orme d’Amérique
• Érablière à ostryer de Virginie et tilleul d’Amérique
• Érablière à bouleau jaune typique
• Érablière à bouleau jaune et hêtre à grandes feuilles
• Érablière à bouleau jaune et frêne noir
• Érablière à bouleau jaune et orme d’Amérique
• Érablière à bouleau jaune et tilleul d’Amérique
• Érablière à hêtre à grandes feuilles typique
• Érablière rouge à sapin baumier
• Érablière argentée à orme d’Amérique
• Érablière argentée à frêne de Pennsylvanie.
L’érablière noire à caryer cordiforme (Carya cordiformis [Wang.] K. Koch) et l’érablière à caryer cordiforme représentent les érablières fertiles du sud-ouest de la province. Situées dans une région particulièrement avantagée sur le plan climatique, elles ne forment plus que des peuplements de faible superficie. Au Québec méridional, les forêts feuillues les plus prédominantes et les mieux connues sont l’érablière à tilleul d’Amérique (Tilia americana L.) et l’érablière à bouleau jaune (Betula alleghaniensis Britt.). L’érablière à tilleul d’Amérique nécessite, pour se régénérer et maintenir une stabilité, une saison de croissance qui varie entre 1600 et 1900 degrés-jours. Composée d’espèces végétales très diversifiées, elle colonise des sols fertiles également très convoités par l’agriculture. En progressant vers le nord ou en altitude, cette association perd graduellement des éléments méridionaux au profit d’espèces végétales un peu plus boréales. L’érablière à ostryer de Virginie (Ostrya virginiana [Mill.] K. Kosh) devient alors un groupement de transition entre l’érablière à tilleul d’Amérique et l’érablière à bouleau jaune.
L’érablière à bouleau jaune subsiste en mosaïque avec des peuplements résineux à l’intérieur de régions qui se caractérisent par des saisons de croissance de plus de 1280 degrés-jours. Ces conditions climatiques plus boréales réduisent la compétition floristique des érablières, à l’avantage de quelques espèces mieux adaptées à ces facteurs environnementaux, et modifient la fertilité des sols. En équilibre avec son environnement, cette érablière se régénère naturellement et maintient sa stabilité.
Les érablières établies sur des stations à drainage modéré demeurent particulièrement influencées par les climats régionaux. L’érablière garde alors le nom de l’association, avec le qualificatif «typique» et est alors nommée groupement climacique.
Outre les facteurs climatiques, le drainage du sol influence considérablement la composition floristique des érablières et constitue le facteur écologique majeur qui permet de distinguer les différentes sous-associations. Ces différences de drainage engendrent des érablières édaphiques. L’habitat de ces érablières renferme sensiblement les mêmes particularités dans l’association à tilleul d’Amérique et celle à ostryer de Virginie.
Ainsi, le chêne rouge (Quercus rubra L.) s’observe sur des sols minces et chauds, caractéristiques des stations sèches, pour former alors une érablière à tilleul d’Amérique et chêne rouge et une érablière à ostryer de Virginie et chêne rouge. Cette sous-association à chêne rouge n’est pas décrite pour l’association à bouleau jaune. À l’intérieur des régions climatiques de l’association à bouleau jaune, le chêne rouge colonise les sommets ensoleillés et bien drainés au détriment d’autres espèces arborées. Le peuplement qui en résulte devient alors une chênaie rouge à érable à sucre ou une érablière à chêne rouge. Cette érablière est considérée par les écologistes comme un peuplement en reconstruction suite à un feu.
Les érablières à tilleul d’Amérique, à ostryer de Virginie et à bouleau jaune renferment également une sous- association à hêtre à grandes feuilles (Fagus grandifolia Ehrh.). Cette sous-association caractérise aussi les stations sèches avec toutefois un sol un peu plus profond.
À l’inverse, les stations à drainage imparfait avantagent des espèces subhygrophiles et donnent les sous- associations à orme d’Amérique (Ulmus americana L.). Dans les stations humides et moins fertiles de l’association à bouleau jaune, l’orme cède la place au frêne noir (Fraxinus nigra Marsh.), pour donner la sous-association à frêne noir.
Enfin, les stations plus fertiles bien avantagées par les facteurs climatiques locaux, permettent à certaines espèces méridionales comme le tilleul d’Amérique ou le noyer cendré (Juglans cinerea L.) de s’établir et de maintenir leur vitalité; on retrouve alors l’érablière à tilleul d’Amérique et noyer cendré.
Les érablières rouges ont fait l’objet de quelques études écologiques. Cependant, la stabilité de ces peuplements et les successions végétales font encore l’objet de controverses. Enfin, il demeure difficile de trouver des études écologiques et descriptives des érablières argentées.
4.2 Types d’erablières et leurs particularités écologiques
4.2.1 Érablière noire à caryer cordiforme
1: < 5% 2:5-9% 3:10-29% 4:30-59% 5:>=60%
Gabriel Roy, Gilles Gagnon, Colette Ansseau avec la collaboration de Maurice Gagnon et Jean-Marc Boivin
Thibault, M., 1985. Les regions ecologiques du Quebec meridional (carte). Min. Ener. et Ress., Quebec.
• Érablière à caryer cordiforme
• Érablière à tilleul d’Amérique typique
• Érablière à tilleul d’Amérique et chêne rouge
• Érablière à tilleul d’Amérique et hêtre à grandes feuilles
• Érablière à tilleul d’Amérique et orme d’Amérique
• Érablière à tilleul d’Amérique et noyer cendré
• Érablière à ostryer de Virginie typique
• Érablière à ostryer de Virginie et chêne rouge
• Érablière à ostryer de Virginie et hêtre à grandes feuilles
• Érablière à ostryer de Virginie et orme d’Amérique
• Érablière à ostryer de Virginie et tilleul d’Amérique
• Érablière à bouleau jaune typique
• Érablière à bouleau jaune et hêtre à grandes feuilles
• Érablière à bouleau jaune et frêne noir
• Érablière à bouleau jaune et orme d’Amérique
• Érablière à bouleau jaune et tilleul d’Amérique
• Érablière à hêtre à grandes feuilles typique
• Érablière rouge à sapin baumier
• Érablière argentée à orme d’Amérique
• Érablière argentée à frêne de Pennsylvanie.
(Caryo cordiformis – Aceretum nigri)
Espèces caractéristiques:
Érable noir, caryer cordiforme, tilleul d’Amérique, frêne d’Amérique, noyer cendré, orme d’Amérique, orme rouge (Ulmus rubra Mühl.), chêne à gros fruits (Quercus macrocarpa Michx.), Celastrus scandens, Anemone cylindrica et autres espèces calcicoles.
Remarque: L’érablière noire à caryer cordiforme demeure particulièrement intéressante par sa grande diversité écologique et sa forte productivité. Ce type d’érablière se prête bien au jardinage afin de favoriser le renouvellement du peuplement. Ces érablières ont considérablement subi l’influence de l’expansion agricole et maraîchère au détriment des zones boisées.
4.2.2 Érablière à caryer cordiforme (Caryo cordiformis – Aceretum sacchari)
Espèces caractéristiques:
Érable à sucre, caryer cordiforme, tilleul d’Amérique, frêne d’Amérique, noyer cendré, chêne à gros fruits, orme d’Amérique, Carpinus caroliniana, Dirca palustris, Adiantum pedatum, Uvularia grandiflora, Viola canadensis, Asarum canadense, Laportea canadensis, Actaea pachypoda.
Remarque: L’érablière à sucre et caryer cordiforme est une érablière très diversifiée en espèces végétales et fort productive. La superficie de ces érablières est grandement réduite par l’expansion agricole et maraîchère. Le maintien de la diversité et de la stabilité de ces peuplements est favorisé par des techniques sylvicoles jardinatoires.
4.2.3 Érablière à Tilleul d’Amérique
(Tilio americanae – Aceretum sacchari)
4.2.3.1 Érablière à tilleul d’Amérique typique
(Tilio americanae – Aceretum sacchari tilietosum americanae)
Espèces caractéristiques:
Érable à sucre, tilleul d’Amérique, frêne d’Amérique, Dirca palustris, Lonicera canadensis, Adiantum pedatum, Laportea canadensis, Actaea pachypoda.
Remarque: Il s’agit du groupement climacique des érablières à tilleul d’Amérique et, de ce fait, montre une certaine diversité dans les conditions d’habitat. La diversité des dépôts est surtout importante dans la région des Appalaches. Le frêne d’Amérique demeure bien représenté dans cette région et est beaucoup moins abondant dans l’ouest de la province. Ce groupement peut couvrir des superficies importantes et est particulièrement recherché pour l’industrie acéricole et forestière. Ces érablières sont surtout localisées dans des régions très agricoles et ont subi des perturbations importantes.
¬
4.2.3.2 Érablière à tilleul d’Amérique et chêne rouge
(Tilio americanae – Aceretum sacchari quercetosum rubrae)
Espèces caractéristiques:
Érable à sucre, tilleul d’Amérique, frêne d’Amérique, chêne rouge, pin blanc (Pinus strobus L.), Vaccinium myrtilloides, Viburnum acerifolium (dans l’ouest de la province).
Espèces méridionales:
Dryopteris marginalis, Viola pensylvanica.
Espèces xérophiles:
Gaultheria procumbens, Lycopodium lucidulum, Chimaphila umbellata.
Remarque: L’érablière à tilleul d’Amérique et chêne rouge est plus diversifiée en espèces arborées et herbacées que la sous-association typique, mais de productivité comparable.
Le chêne rouge est une espèce thermophile, xérique et de lumière. À la limite nord de sa distribution géographique, la forte compétition de l’érable à sucre limite le chêne à ne s’établir que sur des stations xériques. Toutefois, plus au sud, sur des stations très fertiles de la région écologique de l’érablière à caryer cordiforme ou dans la plaine du Saint- Laurent, ce type d’érablière peut se retrouver sur des stations à drainage imparfait et former une érablière à chêne rouge et Dirca palustris. Dans les stations xériques plus nordiques ou en altitude, sur sol mince et très ensoleillé, le frêne d’Amérique, l’ostryer de Virginie puis le tilleul d’Amérique disparaissent graduellement pour former une érablière à chêne rouge. Le feu avantage également la régénération du chêne et peut engendrer une érablière à chêne rouge. Dans l’ensemble, ces groupements sont marginaux et couvrent de faibles superficies.
4.2.3.3 Érablière à tilleul d’Amérique et hêtre à grandes feuilles
(Tilio americanae – Aceretum sacchari fagetosum grandifoliae)
Espèces caractéristiques:
Érable à sucre, tilleul d’Amérique, hêtre à grandes feuilles, ostryer de Virginie, Acer pensylvanicum, Sambucus pubens, Lonicera canadensis, Viburnum alnifolium.
Espèce méridionales:
Polystichum acrostichoides, Adiantum pedatum.
Espèces plus xériques:
Medeola virginiana, Maïanthemum canadense.
Remarque: L’érablière à tilleul d’Amérique et hêtre à grandes feuilles colonise un habitat semblable à l’érablière à tilleul d’Amérique et chêne rouge. Il s’agit de stations xériques et bien ensoleillées, mais le hêtre nécessite un sol un peu plus épais. Par conséquent, ce groupement se trouve sur les hauts versants, à la périphérie de l’érablière à tilleul d’Amérique et chêne rouge, ou sur les hauts sommets arrondis. Dans la région écologique 3e des Appalaches, l’absence du chêne rouge accentue l’importance de l’érablière à tilleul d’Amérique et hêtre à grandes feuilles qui s’observe assez fréquemment dans des stations exposées au sud, mais sur de faibles superficies.
4.2.3.4 Érablière à tilleul d’Amérique et orme d’Amérique
(Tilio americanae – Aceretum sacchari ulmetosum americanae)
Espèces caractéristiques:
Érable à sucre, orme d’Amérique, tilleul d’Amérique, frêne d’Amérique (Fraxinus americana L.), ostryer de Virginie, pruche du Canada (Tsuga canadensis (L.) Carr.), Acer spicatum, Cornus alternifolia, Corylus cornuta, Lonicera canadensis.
Espèces méridionales:
Dryopteris goldiana, Adiantum pedatum, Botrychium virginianum, Osmorhiza claytoni.
Espèces subhygrophiles:
Osmunda cinnamomea, Arisaema atrorubens, Athyrium thelypteroides, Actaea rubra, mitella diphylla.
Remarque: Il s’agit du groupement édaphique des stations humides de l’érablière climacique à tilleul d’Amérique. Deux variantes ont également été décrites dans cette sous-association. Les stations sur alluvions sablonneuses, inondées au printemps et sèches en été, permettent l’installation d’espèces plus xériques pour former la variante à hêtre à grandes feuilles. Dans les stations mal drainées, cette érablière se reconnaît par la présence du frêne noir et périodiquement, du thuya occidental et évolue sur un gleysol humique orthique. Les variantes à frêne noir et à hêtre à grandes feuilles sont qualifiées de très sensibles dans ces habitats où la sapinière à érable rouge s’installe après coupe et la reconstruction du stade final demeure peu probable.
¬
4.2.3.5 Érablière à tilleul d’Amérique et noyer cendré
(Tilio americanae – Aceretum sacchari juglandetosum cinerea)
Espèces caractéristiques:
Érable à sucre, tilleul dAmérique, noyer cendré, frêne d’Amérique, Dirca palustris, Lonicera canadensis.
Espèces méridionales:
Adiantum pedatum, Polystichum acrostichoides, Uvularia grandiflora, Viola canadensis, Allium tricoccum.
Remarque: Ce groupement végétal est le plus méridional des érablières à tilleul d’Amérique. Il renferme un spectre floristique très diversifié et des sols fertiles. Ces érablières forment des superficies restreintes dans des régions à vocation principalement agricole.
4.2.4 Érablière à ostryer de Virginie
(Ostryo virginianae – Aceretum sacchari)
4.2.4.1 Érablière à ostryer de Virginie typique
(Ostryo virginianae – Aceretum sacchari ostryetosum virginianae)
Espèces caractéristiques:
Érable à sucre, ostryer de Virginie, tilleul d’Amérique (peu abondant), Corylus cornuta, Lonicera canadensis, Lycopodium lucidulum, Medeola virginiana, Viola incognita.
Remarque: L’érablière à ostryer de Virginie est un groupement qui fait le lien entre l’érablière à tilleul d’Amérique typique et l’érablière à bouleau jaune typique. Elle forme parfois des peuplements presque purs en érable à sucre, avec quelques ostryers de Virginie épars.
4.2.4.2 Érablière à ostryer de Virginie et chêne rouge
(Ostryo virginianae – Aceretum sacchari quercetosum rubrae)
Espèces caractéristiques:
Érable à sucre, ostryer de Virginie, chêne rouge, pin blanc, Acer pensylvanicum, Lonicera canadensis, Vaccinium angustifolium.
Espèces xériques:
Medeola virginiana, Pteridium aquilinum, Trientalis borealis, Gaultberia procumbens.
Remarque: L’érablière à ostryer de Virginie et chêne rouge ne couvre que de faibles superficies sur des sols minces et secs, parfois en mosaïque avec l’érablière à ostryer de Virginie et hêtre à grandes feuilles. Les strates évolutives de cette sous-association, que ce soit après coupe ou feu, sont encore très peu connues.
4.2.4.3 Érablière à ostryer de Virginie et hêtre à grandes feuilles
(Ostryo viginianae – Aceretum sacchari fagetosum grandifoliae)
Espèces caractéristiques:
Érable à sucre, ostryer de Virginie, hêtre à grandes feuilles, Acer pensylvanicum, Lonicera canadensis, Corylus cornuta, Viburnum alnifolium, Medeola virginiana, Aralia nudicaulis, Maïanthemum canadense, Smilacina racemosa.
Remarque: Parmi l’ensemble des érablières à ostryer de Virginie, cette sous-association à hêtre à grandes feuilles est la mieux décrite et, probablement, la plus prédominante. Il existe une variante à sapin sur les stations très pierreuses. Ce groupement ne dépasse guère le 47′ parallèle et fait rapidement place à l’érablière à ostryer de Virginie et chêne rouge.
4.2.4.4 Érablière à ostryer de Virignie et orme d’Amérique
(Ostryo virginianae – Aceretum sacchari ulmetosum americanae)
Espèces caractéristiques:
Érable à sucre, orme d’Amérique, ostryer de Virginie, Acer pensylvanicum, Lonicera canadensis, Sambucus pubens, Botrychium virginianum, Osmorhiza claytoni, Athyrium filixfemina, Carex intumescens.
Remarque: Généralement plus diversifiée en espèces végétales dans le domaine climacique de l’érablière à bouleau jaune, elle est aussi plus nordique que le groupement climacique.
4.2.4.5 Érablière à ostryer de Virginie et tilleul dAmérique
(Ostryo virginianae – Aceretum sacchari tilietosum americanae)
Espèces caractéristiques:
Érable à sucre, ostryer de Virginie, hêtre à grandes feuilles, tilleul d’Amérique (peu), chêne rouge, cerisier tardif (Prunus serotina Ehrh.) (peu), frêne d’Amérique (peu), Sambucus pubens, Acer pensylvanicum, Polygonum cilinode, Carex arctata, Osmorhiza claytoni.
Remarque: Cette érablière ne couvre pas de grandes superficies et semble assez rare. Elle se rencontre uniquement dans des stations riches en calcaire, seulement dans les Laurentides ou dans des stations très avantagées par des facteurs climatiques dans l’ouest de la province. Dans l’Outaouais, elle est connue sous le nom d’érablière à ostryer de Virginie et frêne dAmérique. Dans les deux régions, il s’agit d’une érablière édaphique à distribution très restreinte. Il existe également une érablière à ostryer de Virginie septentrionale. Elle n’a été décrite que dans le domaine de la bétulaie jaune à sapin, à l’extrémité est de la Gaspésie. Ces peuplements sont généralement de faible hauteur et peu denses.
4.2.5 Érablière à bouleau jaune
(Betulo luteae – Aceretum sacchari)
4.2.5.1 Érablière à bouleau jaune
(Betulo luteae – Aceretum sacchari betuletosum luteae)
Espèces caractéristiques:
Érable à sucre, bouleau jaune, Acer pensylvanicum, Corylus cornuta, Lonicera canadensis, Acer spicatum, Viburnum alnifolium, Taxus canadensis, Dryopteris spinulosa, Aralia nudicaulis, Smilacina racemosa, Streptopus roseus, Viola incognita.
Remarque: Il s’agit du groupement acéricole le plus répandu dans la partie méridionale de la province. L’érablière à bouleau jaune est un groupement climacique, à l’exception de celle située dans le domaine des érablières à tilleul d’Amérique, au sud-ouest de la plaine du Saint-Laurent. Dans ce secteur, l’érablière à bouleau jaune se localise sur les «buttons» ou les sommets convexes bien drainés; elle est alors édaphique. Ce groupement climacique se caractérise par une grande diversité de son habitat. Cette diversité a amené la description de nombreux faciès et variantes dont les deux plus importants sont: le faciès à if du Canada (Taxus canadensis Marsh.) qui consiste en une érablière à bouleau jaune typique sur des sommets et des pentes abruptes en altitude (> 450 m) d’exposition S, S-0, S-E, E; le faciès à sapin baumier sur stations plus pauvres et humides, la variante à Polystichum acrostichoides, qui colonise uniquement des colluvions sur des pentes abruptes et concaves exposées au S-0, S-E et la variante à Rubus pubescens sur stations plus fertiles.
(Betulo luteae – Aceretum sacchari)
(Betulo luteae – Aceretum sacchari betuletosum luteae)
¬
4.2.5.2 Érablière à bouleau jaune et hêtre à grandes feuilles
(Betulo luteae – Aceretum sacchari fagetosum grandifoliae)
Espèces caractéristiques:
Érable à sucre, bouleau jaune, hêtre à grandes feuilles, pruche du Canada, Acer pensylvanicum, Sambucus pubens.
Espèces xérophiles:
Medeola virginiana, Lycopodium lucidulum, Trillium undulatum, Trientalis borealis.
Remarque: En région montagneuse, l’érablière à bouleau jaune et hêtre à grandes feuilles couvre des superficies très importantes. Avec le groupement climacique de l’érablière à bouleau jaune typique, cette érablière édaphique a aussi une grande importance pour l’industrie acéricole et forestière. Ces érablières sur sites bien drainés des hauts versants facilitent les travaux acéricoles et, de ce fait, sont recherchées par les producteurs de sirop d’érable.
4.2.5.3 Érablière à bouleau jaune et frêne noir
(Betulo luteae – Aceretum sacchari fraxinetosum nigrae)
Espèces caractéristiques:
Érable à sucre, bouleau jaune, frêne noir, sapin baumier (Abies balsamea (L.) Mill.), Acer spicatum, Viburnum alnifolium, Lonicera canadensis.
Espèces hygrophiles:
Arisaema atrorubens, Tiarella cordifolia, Onoclea sensibilis, Carex brunnescens.
Remarque: L’érablière à bouleau jaune et frêne noir est un groupement édaphique qui caractérise les stations humides et moins fertiles de l’association à bouleau jaune. Les données dendrométriques de cette sous-association sont assez rares et indiquent une productivité plus faible que l’érablière à bouleau jaune typique.
L’érablière à bouleau jaune et frêne noir située au bas des pentes contient parfois des espèces plus méridionales comme l’orme d’Amérique alors que celle située sur les pentes, plus en altitude, contient des résineux comme le sapin baumier, l’épinette blanche (Picea rubens Sarg.) et l’épinette rouge (Picea glauca (Moench) Voss).
4.2.5.4 Érablière à bouleau jaune et orme d’Amérique
(Betulo luteae – Aceretum sacchari ulmetosum americanae)
Espèces caractéristiques:
Érable à sucre, bouleau jaune, orme d’Amérique, tilleul d’Amérique, frêne d’Amérique, Sambucus pubens, Acer spicatum, Viburnum alnifolium, Lonicera canadensis.
Espèces hygrophiles:
Impatiens capensis, Impatiens pallida, Polystichum braunii, Thalictrum pubescens, Onoclea sensibilis.
Remarque: Ce groupement édaphique, presque toujours situé en bordure d’un cours d’eau, forme de petites superficies. L’érablière à bouleau jaune et orme d’Amérique est rarement décrite dans la littérature et est souvent qualifiée de groupement fragile. Cependant, elle est généralement déboisée par l’acériculteur car elle est peu accessible au printemps. Il s’agit d’un groupement acéricole qui se localise en altitude dans les régions accidentées et il est beaucoup plus nordique que le groupement à tilleul d’Amérique et orme d’Amérique.
Ce groupement est le plus productif de l’association à bouleau jaune. Cependant, la rareté de cet habitat et les superficies restreintes de ces érablières apportent une faible contribution à l’industrie acéricole et forestière.
4.2.5.5 Érablière à bouleau jaune et tilleul d’Amérique
(Betulo luteae -Aceretum sacchari tilietosum americanae)
Espèces caractéristiques:
Érable à sucre, bouleau jaune, tilleul d’Amérique, ostryer de Virginie, frêne d’Amérique, Acer pensylvanicum, Viburnum alnifolium, Lonicera canadensis, Botrychium virginianum, Adiantum pedatum.
Remarque: L’érablière à bouleau jaune et tilleul d’Amérique est un groupement édaphique qui ne se trouve que dans les stations avantagées par les facteurs climatiques. Ce type d’érablière est très recherché par les acériculteurs qui la qualifient d’érablière chaude. C’est aussi un des groupements les plus productifs en terme de matière ligneuse et probablement de produits acéricoles avec l’érablière à bouleau jaune et orme d’Amérique. Les stations bien drainées à mi-pente caractérisent la variante à ostryer de Virginie. La variante à Dirca palustris s’observe au bas des pentes, sur des stations plus fertiles modérément à imparfaitement rainées, exposées à l’ouest et principalement localisées dans les basses Laurentides. Enfin, la variante à frêne noir se trouve sur des stations de bas de pente, dont le sol est plus acide et modérément à imparfaitement drainé.
4.2.6 Érablière à hêtre à grandes feuilles
(Fago grandifoliae – Aceretum sacchari)
4.2.6.1 Érablière à hêtre à grandes feuilles typique
(Fago grandifoliae – Aceretum sacchari fagetosum grandifoliae)
Espèces caractéristiques:
Érable à sucre, hêtre à grandes feuilles (très abondant), bouleau jaune (rare), ostryer de Virginie, épinette blanche, Acer pensylvanicum, Sambucus pubens, Viburnum alnifolium, Lonicera canadensis.
Espèces plus xériques:
Medeola virginiana, Lycopodium lucidulum, Trillium undulatum, Clintonia borealis, Trientalis borealis.
Remarque: Ce groupement prédomine surtout dans les régions où le chêne rouge est plus rare et où son habitat ressemble beaucoup aux érablières à chêne rouge. Il s’observe généralement dans une séquence écologique où le bas des pentes est colonisé par l’érablière à bouleau jaune typique, la mi-pente par l’érablière à bouleau jaune et hêtre à grandes feuilles, pour finalement arriver sur le haut des pentes très ensoleillées et sur les sols plus minces avec cette érablière à hêtre à grandes feuilles typique. Toutefois, ce groupement est assez proche de l’érablière à bouleau jaune et hêtre et beaucoup d’écologistes forestiers préfèrent l’introduire dans cette association comme sous-association. En outre, les coupes fortes avantagent parfois le hêtre au détriment du bouleau jaune et peuvent favoriser cette sous-association.
4.2.7 Érablière rouge à sapin baumier
(Abieto balsameae – Aceretum rubri)
Espèces caractéristiques:
Érable rouge, sapin baumier, bouleau jaune, pruche du Canada, épinette rouge, Acer spicatum, Corylus cornuta, Lonicera canadensis, Viburnum cassinoides.
Espèces boréales:
Oxalis montana, Clintonia borealis, Lycopodium lucidulum.
Espèces subhygrophiles:
Osmunda cinnamomea, Symplocarpus foetidus.
Remarque: Plus d’une dizaine d’associations d’érable rouge ont été décrites par les phytosociologues; seule l’érablière rouge à sapin est qualifiée de stable dans son milieu naturel. Ce groupement est étroitement lié au drainage du sol. C’est un groupement de transition entre les stations plus humides de la sapinière à thuya occidental et les stations un peu plus sèches de l’érablière à bouleau jaune et frêne noir. Les secteurs humides des plaines délaissées par l’agriculture forment une mosaïque de ces trois types de peuplement sur des superficies assez importantes. Ces types d’érablières se rencontrent le plus fréquemment sur des habitats très perturbés.
4.2.8 Érablière argentée à orme dAmérique
(Ulmo americanae – Aceretum saccharini)
Espèces caractéristiques:
Érable argenté, orme d’Amérique, frêne de Pennsylvanie, frêne noir, noyer cendré, Alnus rugosa, Ilex verticillata, Carnus stolonifera, Spiraea latifolia.
Espèces hygrophiles:
Onoclea sensibilis, Lycopus uniflorus, Galium asprellum, Carex crinita, Osmunda regalis, Malictrum pubescens (lieux fertiles).
Remarque: Ces érablières colonisent les stations inondées pendant une période plus ou moins longue au printemps. Elles ont fait l’objet de peu d’études écologiques jusqu’à présent et demeurent encore assez inconnues. En outre, ces érablières se développent dans des habitats fortement perturbés par des coupes et sont réduites à l’état de vestiges. Dans certains sites, l’orme d’Amérique se régénère très bien et pourrait supplanter l’érable argenté. Il est donc difficile de prévoir l’évolution de ces érablières.
4.2.8.1. Érablière argentée à frêne de Pennsylvanie
(Fraxino pensylvanicae – Aceretum saccharini)
Espèces caractéristiques:
Érable argenté, frêne de Pennsylvanie, orme d’Amérique, caryer ovale (Carya ovata (Mill.) K. Koch), chêne à gros fruits, noyer cendré, frêne noir, saule noir (Salix nigra Marsh.), Cornus stolonifera, Cephalanthus occidentalis, Ilex verticillata, Sambucus canadensis, Vitis riparia.
Espèce hygrophiles:
Laportea canadensis, Onoclea sensibilis, Matteuccia struthiopteris.
Remarque: Ce type d’érablière ne fait l’objet que de peu d’études phytosociologiques. Le nom de cette érablière désigne, en réalité, un ensemble de groupements arborés ripariens qui se distinguent en fonction du régime hydrique. Ainsi du bord de l’eau vers les hautes berges, il existe une gradation dans la composition floristique. Cette gradation est, dans l’ordre:
• L’érablière argentée à Cephalanthus occidentalis
• L’érablière argentée à Onoclea sensibilis
• L’érablière argentée à Laportea canadensis
• L’érablière argentée à frêne de Pennsylvanie, parfois précédée de l’érablière argentée à Matteuccia struthiopteris. Puis, dans les régions plus chaudes de la province, l’érablière argentée à caryer ovale, l’érablière argentée à chêne bicolore (Quercus bicolor Willd.).
Certaines érablières sont parfois absentes de cette succession végétale. Cette succession d’habitats ripariens est fonction des marées et de la topographie des berges.
Sur le bord des cours d’eau, ces érablières font place à des groupements herbacés adaptés aux inondations répétitives. Ces érablières sont principalement localisées à l’intérieur de régions à forte densité de population. L’expansion résidentielle, l’établissement de quais et autres facteurs anthropiques ont fortement perturbé ces érablières argentées.
4.3 Quelques Caractéristiques écologiques des espèces arborées de l’érablière
Le tableau 4.1 donne quelques caractéristiques écologiques des espèces arborées qui composent les peuplements forestiers acéricoles. Les caractéristiques écologiques de ces espèces facilitent la compréhension de la distribution géographique et des affinités écologiques des groupements végétaux. Ces espèces sont des indicateurs biologiques qui participent à la classification des peuplements forestiers et préconisent des techniques d’aménagement plus adaptées aux exigences écologiques de chaque groupement acéricole.
Tableau 4.1 Caractéristiques écologiques des espèces arborées de l’érablière
5 Sols des écosystémes d’érablière
Fernand Pagé et Jean-Louis Brown
5.1 Caractérisation du microrelief dans les érablières
Dans les érablières, la surface du sol est caractérisée par un terrain constitué principalement de micro-buttes et de micro-dépressions plus ou moins apparentes, appelées ici bosses et creux. Sous la forêt feuillue climacique, par exemple, environ 30 % des bosses peuvent être très accusées et, de ce fait, perceptibles d’un premier coup d’oeil.
En y regardant de plus près, on s’aperçoit qu’il s’y dessine aussi toute une gamme de micro-formes allant des bosses bien apparentes jusqu’aux bosses à peine perceptibles ressemblant à des replats plus ou moins ondulés ou des plateaux peu élevés.
Les dimensions de ces bosses dépendent de la taille, de l’espèce et de la vigueur des arbres qui ont été déracinés, ainsi que du temps écoulé depuis. On observe dans la forêt feuillue des bosses mesurant entre 2 et 7 m de longueur, 1,5 et 3 m de largeur et 30 cm à 1 m de hauteur.
Il existe également des creux plus ou moins importants, dont la longueur est fonction de celle de la bosse à laquelle ils sont associés et dont la largeur, souvent réduite à une étroite gouttière, dépend de l’âge de la bosse. La profondeur des creux diminue également avec le temps.
Il peut exister aussi de véritables micro-replats qui ne sont pas d’anciennes bosses aplaties avec le temps. Ils sont cependant toujours de petites dimensions et beaucoup plus rares que les autres microformes déjà énumérées.
L’accumulation de matière organique en plus grande épaisseur dans les creux et autour des obstacles vient atténuer le microrelief et en masquer certains traits mineurs (Brown, 1979; McFee et Stone, 1965).
Cette dernière observation met en évidence un premier effet du microrelief qui favorise l’accumulation des feuilles mortes en plus grande quantité dans les creux par rapport aux sommets des bosses et, par la suite, des quantités plus importantes de matière organique.
Dans les érablières à bouleau jaune des basses Laurentides par exemple, la couche H de l’humus peut mesurer aussi peu que quelques millimètres au sommet des bosses, alors qu’elle peut atteindre plusieurs centimètres dans les creux. Dwyer et Merriam (1981) ont estimé pour une forêt de hêtres et d’érables à sucre en Ontario, que le poids sec de la litière sur les replats et dans les dépressions était respectivement égal à trois fois et à six fois celui des sommets de bosses. Dans une forêt de feuillus nordiques du New Hampshire, Hart et al. (1962) signalent que l’épaisseur de l’humus sur les pentes des monticules était environ le double de celle rencontrée au sommet et que, dans les dépressions, cette épaisseur atteignait environ quatre fois celle observée sur les sommets.
Une première conséquence de ces grandes différences dans l’accumulation de la litière et, par la suite, dans l’épaisseur de l’humus, est une isolation différente du sol selon les éléments ou parties du microrelief. Ceci se traduit par un retard dans le réchauffement de la surface du sol minéral au printemps, de même que par des températures moins variables et une moyenne plus froide dans les dépressions au cours de la saison estivale (Dwyer et Merriam, 1981). En période de basse température ou pendant l’hiver en l’absence d’un couvert de neige, les bosses seraient plus susceptibles au gel. Hart et al. (1962) ont observé dans la forêt expérimentale de Hubbard Brook, que le gel affectait principalement le sommet des bosses, où l’humus est le plus mince, tandis que dans les creux, le gel était absent.
En plus de ces variations de température, on constate également des différences dans le régime hydrique en fonction du microrelief. Cependant, à part une accumulation de neige plus grande dans les creux et sa fonte plus tardive, il n’y a pas, dans les conditions normales sous nos forêts, de ruissellement vers les creux.
Même pendant de gros orages, nous n’avons pu observer en forêt de ruissellement à la surface du sol. Celui-ci est empêché en partie par le couvert végétal, qui intercepte une partie de la précipitation et par l’effet de buvard de l’humus. En ce sens, la couche de feuilles mortes sous les érablières, par exemple, est particulièrement efficace. Elle protège, dans un premier temps, le sol contre l’érosion en absorbant l’impact des gouttelettes d’eau puis, dans un deuxième temps, en absorbant les gouttelettes elles-mêmes.
En conséquence, bien que le microrelief puisse jouer un rôle important en orientant et en captant dans les dépressions l’eau de ruissellement, cela ne se produit généralement pas sous nos conditions normales en forêt, car il n’y a pas de ruissellement.
Aussi, les différences d’humidité observées dans le sol entre les bosses et les creux sont dues à des différences dans l’exposition à l’évaporation, causée par le microrelief lui-même, à une plus grande isolation du sol dans les creux, produite par une couverture d’humus plus importante et, enfin, à l’égouttement plus rapide du sol dans les bosses, résultant d’une plus grande porosité et d’une texture plus grossière, particulièrement dans les bosses les plus récentes. Ces variations de texture et de porosité seront expliquées par la genèse du microrelief.
5.2 Genèse du microrelief en bosses et creux et impact sur la variabilité du sol dans les érabliéres
En forêt, le microrelief résulte principalement du chablis ou du renversement des arbres par le vent (Brown, 1977; Brown et Martel 1981). On peut classifier les renversés en quatre types (figure 5-1), trois types se distinguant selon l’angle fait avec l’horizontale par la «galette» de sol arrachée par les racines et un quatrième type, en fonction de l’emplacement du creux qui se trouve ici exceptionnellement du côté du tronc. Cette classification permet d’expliquer le mode de sédimentation du matériel et la structure des différentes parties de la bosse.
En terrain à pente faible, la galette sol-racines se dresse selon un angle qui s’éloigne peu de la verticale (figure 5.1A). Brown (1977) a qualifié de «normal» ce type de renversé. Voyons schématiquement le bouleversement et le réarrangement des horizons du sol qui en résultent. Le matériel arraché par les racines forme avec celles-ci une galette dressée perpendiculairement à la pente du terrain. Soumis à la fois aux agents atmosphériques et à la gravité, la galette de sol s’érode et se désagrège lentement à mesure que les micro- organismes décomposent le système racinaire qui forme son squelette. Le matériel arraché retourne ainsi lentement au sol, pour combler partiellement le creux et donner naissance à une bosse. Cette dernière, d’abord très accusée, devient avec le temps de plus en plus arrondie et aplatie.
Figure 5.1 Illustration des quatre principaux types de renversés
A) le renversé «normal»; C) le renversé incomplet; et
B) le renversé en pente forte; D) le renversé bouteur qui repousse le sol, pour produire la
micro-cuvette du côté du tronc (Brown et Martel, 1981)
La nature du matériel et le mode de sédimentation sont différents selon qu’on se trouve du côté du tronc ou du côté du creux. Du côté du creux, le matériel sédimenté provient de la roche-mère et de la base du solum. Il s’agit donc d’un matériel pédogénétiquement peu évolué. Il se dépose plutôt sous forme particulaire à mesure que l’eau et la glace l’arrachent de la galette solracines et que la gravité l’entraîne dans le creux. Il finit peu à peu par combler la plus grande partie du creux, ne laissant, dans les renversés les plus vieux, qu’une étroite gouttière partiellement masquée par la litière et l’humus.
Du côté du tronc, le matériel formé des horizons humifères de surface et de la partie supérieure du solum se dépose de façon différente. Protégé de l’érosion par l’humus et une plus grande cohésion des particules, le matériel arraché retourne au sol en blocs, en s’affaissant verticalement et en se retournant pour exposer un sol minéral plus ou moins évolué pédogénétiquement, selon l’épaisseur des couches retournées. Le profil adjacent au renversé se trouve ainsi fossilisé; celui-ci est d’abord recouvert d’une couche humifère, laquelle est enterrée à son tour par une couche minérale déposée en blocs dont l’épaisseur diminue à mesure qu’on s’éloigne du centre du renversé.
De chaque côté de la galette sol-racines se forment donc deux talus très différents. Le talus situé du côté d’où est venu le coup de vent qui a déraciné l’arbre est appelé talus «amont», tandis que l’autre talus est qualifié de talus «aval» (Brown, 1977). Au centre de ces deux talus, la base de la galette sol-racines persiste dans le type de renversé «normal», pour en constituer en quelque sorte l’épine dorsale formée par les horizons A et la partie supérieure de l’horizon B, qui se retrouvent ici dans une position perpendiculaire à leur position normale.
Ce mode de sédimentation se modifie progressivement à mesure que la pente du terrain s’accentue, pour donner dans les pentes fortes un deuxième type de renversé (figure 5.1B). Dans ces dernières conditions, le matériel de la galette sol-racines tend à se sédimenter de façon de plus en plus importante du côté du talus aval par rapport au talus amont qui peut devenir quasi nul sur les pentes très fortes. Le comblement du creux se fait alors presque entièrement par la matière organique accumulée au fil des ans par la chute des feuilles.
Un troisième type de renversé, appelé renversé incomplet, se caractérise, contrairement au précédent, par l’angle aigu que fait la galette sol-racines avec l’horizontale (figure 5.1C). Ce renversé se produit lorsque l’arbre déraciné demeure accroché à la cime ou au tronc des arbres voisins, ce qui l’empêche de se renverser complètement. L’arbre ainsi déraciné peut continuer à vivre encore pendant plusieurs années, retenant entre ses racines la majeure partie du sol arraché. Avec le temps, celui-ci retournera entièrement dans le creux à mesure que la décomposition des racines progressera.
Enfin, dans le quatrième type de renversé (renversé bouteur) (figure 5. 1 D), le système racinaire, pivotant autour d’un axe perpendiculaire au tronc et tangent à la surface du sol, repousse ce dernier vers le côté opposé au tronc pour creuser, exceptionnellement dans ce cas-ci, le creux du côté du tronc. Le profil de sol bascule en quelque sorte autour de cet axe. Du matériel provenant de la base du solum et même de la roche-mère est repoussé en surface du côté du talus amont tandis que du côté aval, les horizons du sommet du profil s’inclinent pour constituer le talus aval qui borde ici le creux.
Les descriptions précédentes donnent une vue schématisée de la perturbation des horizons du sol par les renversés et de la structure interne des microreliefs qui en résultent. Une analyse plus détaillée ferait voir une complexité plus grande encore dans la perturbation du sol et dans la sédimentation du matériel déplacé. Cependant, les grands traits des processus décrits ici sont suffisants pour illustrer la complexité des phénomènes en cause et les relations qui existent entre le microrelief et la variabilité rencontrée sur de courtes distances, dans les propriétés physico- chimiques des sols forestiers.
Soulignons que le chablis affecte quelque fois en même temps la quasitotalité des arbres sur des superficies assez grandes. Mais le plus souvent, c’est un phénomène plus discret, qui se produit sporadiquement dans l’espace et dans le temps. Cependant, au cours des siècles, il finit par retourner la plus grande partie du sol sous forêt. Il explique le fait que le parterre forestier soit jonché de bosses alternant avec des creux de tailles et de dimensions différentes dépendant de la taille de l’arbre et de l’espèce renversée, mais aussi de l’âge de la bosse.
La datation au C14 de profils de sol voisins, dans une érablière à bouleau jaune du Témiscamingue, illustre bien le résultat du phénomène décrit précédemment. L’âge apparent (MRT) du profil le plus âgé atteignait 2 430 ± 120 ans (QU-452), soit le double ou presque de celui de deux autres profils, âgés de 1350 ± 90 ans (QU-453) et de 1260 ± 90 ans (QU-454) et situés respectivement à un et deux mètres du premier (Brown et Martel, 1981).
Il peut donc exister et il existe en fait, côte à côte, des profils de sol d’âges différents qui évoluent ou ont évolué à partir d’un matériel de départ s’apparentant pour les uns au dépôt frais ou à la roche-mère originale et, pour d’autres, à partir d’horizons ou parties d’horizons déjà fortement évolués péclogénétiquement.
À ces différences dans le sol, induites par les renversés lors de l’édification du microrelief, s’ajoutent, comme nous l’avons vu dans la première partie, les effets dus au microrelief lui-même. Celui-ci module très localement l’expression des facteurs pédogénétiques en créant des différences dans l’épaisseur de l’humus, le microclimat, le régime hydrique, les populations de micro-organismes, etc. Pagé et Berrier (1983), Pagé (1987a) et Pagé et Guillet (1991) décrivent l’alternance, liée au microrelief et à son incidence sur la profondeur de la nappe phréatique, de podzols bien drainés et de podzols mal drainés ou même de gleysols dans divers dépôts.
Aussi, ne faut-il pas s’étonner que dans une même station, les profils de sol varient sur de courtes distances (de l’ordre du mètre) au point même de transgresser assez souvent les classes taxonomiques.
Les chablis ne sont pas seuls en cause. Il existe d’autres facteurs, comme les animaux (fourmis, rongeurs, lombrics, etc.), les cycles gel-dégel et humidification-dessiccation qui créent des microreliefs particuliers. Contrairement aux chablis, qui sont étroitement associés aux forêts et généralisés dans ces dernières, ces autres facteurs peuvent être actifs en l’absence d’un couvert ligneux. Cependant, ils nécessitent eux aussi, pour se manifester, des conditions particulières.
Pour ne mentionner que deux de ces facteurs, soulignons que les fourmis, qui érigent des monticules, sont particulièrement actives en terrain déboisé ou dans les clairières, alors que les géliformes produites par les cycles gel-dégel se retrouvent dans certains sols à drainage déficient.
5.3 Dynamique et évolution du sol
Tous ces facteurs, qui créent des microreliefs et qui bouleversent, mélangent, homogénéisent ou fossilisent les horizons du sol, se manifestent souvent sporadiquement et de façon bien localisée dans l’espace et dans le temps. Ils s’opposent ou freinent localement l’expression des processus pédogénétiques qui visent à la différentiation du solum en horizons bien distincts (Brown et Gangloff, 1980; Brown, 1983).
Le sol est donc soumis à des forces antagonistes qui le façonnent et le remodèlent sans cesse. Le microrelief et les variations des propriétés du sol qui lui sont associées résultent donc du dynamisme du sol, lui-même lié à celui des différents écosystèmes dont il est une composante importante. Le sol, comme les écosystèmes eux-mêmes, est en perpétuelle évolution. Cette évolution se fait au moyen de cycles successifs, où le point d’aboutissement d’un des cycles devient le point de départ du suivant. Ils ne forment pas de boucles fermées, car chacun de ces cycles laisse sa marque dans l’écosystème. Ils s’enchaînent plutôt pour former une spirale évolutive (Brown, 1983).
Pour illustrer ce concept, voyons un segment de cette spirale évolutive depuis la déglaciation jusqu’à nos jours, dans une station actuellement colonisée par l’érablière à bouleau jaune typique (Brown, 1981) au Témiscamingue. Dans cette station, le till hérité de la dernière glaciation évolue, depuis environ 10 000 ans, sous l’action conjuguée du climat et de la végétation.
D’après la morphologie et les propriétés chimiques de certains profils de sol rencontrés dans cette érablière, ceux-ci n’ont pu se développer que sous des conditions pédogénétiques (de végétation et de climat) différentes de celles qui prévalent actuellement (Brown, 1977, 1981). Comme l’a suggéré également Richard (1977, 1978) à la suite d’analyses polliniques effectuées plus à l’est dans le Québec méridional, il semble logique de penser qu’après le retrait du glacier et le réchauffement progressif du climat, la colonisation des terrains dénudés s’est faite par l’envahissement successif de la région par les grandes formations végétales qu’on trouve aujourd’hui plus au nord. Elles se seraient succédées, dans la station étudiée, depuis le désert périglaciaire jusqu’à la végétation actuelle.
La figure 5.2 illustre une caténa de paléo-séries évolutives (chacune des grandes boucles de la spirale) telles qu’elles ont pu se succéder dans la station étudiée depuis le retrait du glacier. Chacune des grandes boucles marque un réchauffement du climat et l’envahissement du milieu par une végétation plus méridionale, avec l’impact qu’on connaît sur le sol. Lors du passage d’une boucle à une autre, la végétation plus septentrionale a dû céder sa place, victime de chablis, de feux ou d’épidémies. Ces deux derniers phénomènes sont souvent suivis du chablis avec les effets sur les sols dont on vient de voir un aperçu.
Figure 5.2 Illustration de l’évolution d’un sol forestier avec les facteurs et processus en cause, depuis la déglaciation jusqu’à nos jours, dans une station d’érablière à bouleau jaune du Témiscamingue, Québec (Brown, 1983)
À l’intérieur des grandes boucles se dessine aussi un boudin de petites boucles qui représentent les successions de stades appartenant à une même série évolutive de végétation. Dans ces petites boucles, le sol continue d’évoluer sous l’action combinée d’un même climat et des différentes végétations pionnières, transitoires et climaciques qui s’y succèdent. Chacun des stades de la végétation ajoute sa marque sur un sol déjà façonné par les végétations précédentes. Cette évolution, à l’intérieur d’une même série évolutive, sous un climat quasi constant (hormis quelques petites oscillations), décrit donc également des spirales à l’intérieur des grandes boucles.
Encore aujourd’hui, la végétation et le climat actuels continuent de se conjuguer pour ajouter leurs effets aux profils de sol hérités des écosystèmes précédents. Localement cependant, pour les profils récemment perturbés par les chablis, les animaux, les cycles gel-dégel, etc., ces facteurs pédogénétiques s’expriment, comme nous l’avons vu, sur des roches-mères constituées de matériaux plus ou moins évolués provenant de différentes parties du solum, voire du régolite peu ou pas encore pédogénétiquement altéré. Il en a été de même dans le passé, de sorte qu’on peut retrouver encore dans le sol l’empreinte d’une évolution plus ou moins longue en fonction de la nature des perturbations et du temps écoulé depuis la dernière perturbation.
Cette perpétuelle évolution du sol, avec la complexité des facteurs en cause, est donc responsable de sa grande variabilité et des difficultés rencontrées par le pédologue qui tente de l’étudier, de l’échantillonner, de le décrire, de le classifier et de le cartographier. Le microrelief trahit l’existence de ces phénomènes, mais ne reflète que partiellement l’ampleur de la variabilité du sol.
5.4. Sols acides aérés
5.4.1 Classification des sols
Les sols acides occupent de vastes territoires au Québec, plus particulièrement dans les régions où se développent les érablières à bouleau jaune, comme c’est le cas dans les Appalaches et les Laurentides. Un grand nombre de ces sols, de nature filtrante, et plus particulièrement sur les bosses du microrelief, ont connu des transformations sous l’action des processus de la podzolisation. On y retrouve donc des sols fortement podzolisés, podzols humo- ferriques ou ferro-humiques, ou des sols faiblement podzolisés, brunisols dystriques, éluviés ou sombriques, l’ensemble de ces sols se développant sur des dépôts à texture loameuse à sableuse (figure 5.3). Il importe de rappeler que dans les dépôts morainiques acides, on observe, entre 50 et 80 cm environ de profondeur, la présence d’un horizon compact et dur, appelé horizon fragique (ex. BCx) qui limite la pénétration des racines. Les érablières à bouleau jaune ou à hêtre se développant sur les dépôts les plus filtrants, tels les dépôts morainiques ou fluvio-glaciaires, sont souvent caractérisées par des sols fortement podzolisés, donc marqués par une différentiation d’horizons podzoliques (Ae, Bf, Bhf) bien développés.
Figure 5.3 Représentation schématique de profils de sol (solum) dans les érablières
5.4.2 Phénomène de la podzolisation
Les deux principales théories sur la formation des sols podzolisés (podzols et brunisols dystriques éluviés) reposent sur l’interprétation de la nature des composés dissous par divers réactifs, tels le dithionite-citrate-bicarbonate (Mehra et Jackson, 1960), l’oxalate (Tamm, 1922), le pyrophosphate de sodium (McKeague, 1967) et le tétraborate- hydroxyde de sodium (Bruckert et Metche, 1972). Ces réactifs permettent de définir quatre formes principales de composés, les composés ferrugineux et alumineux complexés ou non à la matière organique (Mc Keague et al., 1971; Guillet et Souchier, 1979; Farmer et al., 1983; Jeanroy et al., 1984). La première théorie est basée sur la migration du fer (Fe) et de l’aluminium (AI) à travers le profil, sous forme de complexes avec les acides organiques, et l’accumulation de ces complexes dans les horizons B du sol (Duchaufour, 1977). La seconde théorie repose sur la migration des silicates d’hydroxyaluminium et de colloïdes minéraux mixtes ainsi que sur la formation de complexes organo-minéraux au niveau même de l’horizon B podzolique (Farmer et al., 1983). C’est pourquoi la caractérisation des différents composés de fer et d’aluminium, ainsi que l’abondance absolue et relative des complexes organo-métalliques ont servi de critères diagnostiques pour identifier les podzols (Commission canadienne de pédologie, 1978).
Toutefois, que l’on soit pour ou contre l’une ou l’autre des théories, les chercheurs sont unanimes pour dire que les processus de formation d’une grande abondance de substances préhumiques et humiques sont caractéristiques du phénomène de la podzolisation. En effet, sous des conditions climatiques froides et humides ainsi qu’en raison des propriétés acides et filtrantes des sols, comme c’est le cas des érablières à bouleau jaune, les végétaux morts qui s’accumulent à la surface des sols se dégradent lentement sous l’action des enzymes fournies par la cellule végétale ou encore par les micro-organismes, pour donner d’importantes quantités de composés organiques simples: acides aliphatiques et surtout acides et polymères phénoliques (Bruckert, 1979; Sauvesty et al., 1993). Ces composés de faible poids moléculaire ont une existence éphémère et se transforment, par polycondensation sous l’action de micro-organismes ou au cours de périodes humectation-dessication, en des composés organiques polymérisés, tels des acides fulviques et humiques (Robert et al., 198 1). Il importe de souligner que la déshumification est relativement lente dans ces sols en raison du climat froid, de l’acidité du sol, de la grande abondance de l’aluminium et de la difficulté pour les micro-organismes d’utiliser l’azote (N), d’abord complexé par les composés phénoliques (tanins-protéines), puis “emprisonné” dans les composés organiques humifiés. La minéralisation des acides organiques est donc faible dans les sols podzolisés et peut s’échelonner, dans le cas des érablières, sur plusieurs centaines d’années (Brown et Martel, 1981; Pagé et Guillet, 1991).
Des études lysimétriques réalisées sur des sols acides d’érablières des Appalaches (Pagé, 1987a, 1987b), ont indiqué que plus de 1 t ha-1 an-1 d’acides organiques solubles provenant de la décomposition des résidus végétaux serait entraînée par l’eau de gravité vers les horizons plus profonds du sol. Cette migration serait accompagnée par environ 200 kg ha-1 an-1 d’éléments minéraux [calcium (Ca), magnésium (Mg), potassium (K), aluminium (AI) et fer (Fe)]. La matière organique à poids moléculaire élevé s’accumule principalement dans les horizons H-Ah (figure 5-1), constituant ainsi avec les horizons L et F l’épisolum humifère. La matière organique à poids moléculaire plus faible migre principalement vers les horizons plus profonds (Robert et al., 1981; Pagé et De Kimpe, 1989). Cette dernière occasionne alors l’altération de minéraux dans les premiers centimètres du sol, avant de précipiter sous la forme de complexes organométalliques de fer et d’aluminium à un niveau plus bas dans le profil. Il semble que les acides fulviques et humiques interviennent davantage dans le transport du fer et de l’aluminium, alors que les acides organiques simples (substances préhumiques) agissent préférentiellement sur l’altération des minéraux. Une partie du fer et de l’aluminium des complexes organo-minéraux accumulés dans les horizons B passe ensuite sous l’action de la biodégradation (Dommergues et Manqenot, 1970), ou encore, au cours de processus saisonniers de «polymérisation- depolymérisation» (Turenne, 1975), de l’état de complexes à l’état d’hydroxydes amorphes, voire à l’état cristallisé (Pagé et De Kimpe, 1987).
Une étude réalisée dans deux érablières du Québec a montré que le phénomène de la podzolisation agit sur les sols au cours de deux périodes principales (Pagé, 1987a, 1987b): au printemps, dès la fonte des neiges et jusqu’au début de juin et à l’automne, de la chute des feuilles jusqu’aux premières neiges. C’est donc au cours de ces périodes que les acides organiques et les cations sont entraînés vers les horizons B, ou éliminés hors du profil. À partir de juin jusqu’à la chute des feuilles, on observe peu de migration des solutions du sol, mais une activité accrue des organismes telluriques.
Ainsi, dans les sols podzolisés des érablières, on peut observer certains horizons caractéristiques se développant sous l’épisolum humifère (figure 5.3): un horizon d’altération minérale de couleur blanc cendreux (horizon Ae) suivi d’horizons d’accumulation relativement colorés (Bf, Bhf ou Bh, Bfj ou Bm) par les substances organiques et les hydroxydes de fer (brun jaune, brun rouge ou brun noir).
Dans de nombreuses érablières cependant, notamment celles de la région des Appalaches, l’activité relativement intense de la pédofaune au cours de la saison chaude, plus particulièrement des micro-arthropodes et des enchytraeïdes, provoque un “brassage” des horizons minéraux superficiels et limite le développement de l’horizon Ae. Cet horizon apparaît alors discontinu dans les sols, souvent en forme de glosses sous des pierres ou de grosses racines.
5.4.3 Impact de la podzolisation sur la disponibilité des éléments nutritifs
Il existe dans les sols podzolisés des érablières deux niveaux relativement plus riches en éléments nutritifs qu’ailleurs dans le profil: les horizons F-H de l’épisolum humifère caractérisés par la libération des éléments nutritifs au cours des processus de décomposition de la matière organique par les organismes telluriques; les horizons B podzoliques marqués par l’accumulation des cations. On verra au chapitre 6 que l’érable, pour assurer son existence, réagit aux conditions du milieu en émettant dans les deux niveaux les plus riches, une plus grande abondance de radicelles.
Ainsi, lors de la chute des feuilles ou lorsque la plante ou une partie de la plante (tiges, racines) meurt, ou encore par l’intermédiaire des pluviolessivats, les éléments absorbés par l’arbre retournent au sol pour être partiellement repris par les racines. Le cycle biogéochimique, largement décrit au chapitre 7, est alors complété. Dans ces sols, l’accumulation des cations dans les horizons B podzoliques n’est donc pas uniquement liée à des altérations minéralogiques par les acides organiques, mais également grâce au cycle biogéochimique. Dans les sols podzolisés, les horizons de l’épisolum humifère issus de la décomposition des résidus végétaux fournissent plus de cations libres que les horizons minéraux sous l’action agressive des acides organiques (Pagé, 1987a, 1987b); ainsi, dans ces sols pauvres et acides, le cycle biogéochimique assure une présence permanente des éléments nutritifs, non seulement dans l’épisolum humifère, mais également dans les horizons B podzoliques.
Cependant, alors que la plupart des cations précipitent sous forme de complexes organiques ou d’hydroxydes dans les horizons B, les cations K, Ca et Mg pouvant être à nouveau libérés de la transformation de ces complexes, le phosphore (P) est mobilisé dans les horizons B par les hydroxydes d’aluminium, devenant ainsi inutilisable par l’arbre (Giroux et Tran, 1985; Paré et Bernier, 1989). Comme une quantité relativement importante des autres cations de migration est éliminée hors du profil au cours de fortes pluies ou à la fonte de la neige, il importe de souligner qu’à long terme, dans les sols podzolisés, il y a diminution de la fertilité des sols.
La podzolisation dans les sols acides et filtrants des érablières dépend principalement du climat. Par exemple, une saison de croissance plus froide combinée à des précipitations plus importantes accroîtront les mécanismes de lessivage et d’acidification liés au phénomène de la podzolisation. Ces processus auront des effets qui se feront sentir sur les végétaux et l’activité biologique des sols (Lachance, 1985; Pagé et al., 1992). Soulignons que les polluants atmosphériques pourraient également occasionner une intensification des processus podzoliques en acidifiant davantage les sols (Hendershot et Jones, 1989; Hendershot, 1990; Laflamme, 1990).
Cette acidification entraîne diverses modifications de propriétés physicochimiques du sol, dont celles liées à son pouvoir tampon, lequel est régi par divers constituants, selon le pH. Par exemple, entre 8,6 et 6,2, le principal constituant tampon est le carbonate de calcium, qui se dissoudra au cours des processus d’échanges avec les ions H+ libérés par la présence d’ions organiques, sulfates ou nitrates. Lorsque ce réservoir est épuisé par élimination du calcium, ce sont les argiles (colloïdes minéraux et organiques) et leur pouvoir d’échanger des cations qui jouent le rôle de tampon en échangeant des éléments métalliques contre des ions H+. Lorsque le réservoir cationique des argiles est épuisé et que le pH a atteint 4,2, c’est l’aluminium échangeable issu de la décomposition des silicates qui devient alors le principal cation d’échange. C’est généralement lorsque le tampon du sol voisine celui de l’aluminium qu’agissent de façon intense les processus podzoliques. Or, dans les sols acides des érablières à bouleau jaune et à hêtre, le pH varie généralement entre 3,5 et 5,0. Il est donc permis de penser que dans ces sols, le pouvoir tampon lié aux argiles est fragile. Le pH et les quantités des éléments nutritifs du sol diminuent donc, alors que les teneurs en aluminium libre augmentent sous l’action intense des processus podzoliques. Or, l’absorption des cations par les racines n’est pas alors uniquement réduite parce que ceux-ci sont moins abondants, mais également parce qu’il existe des interactions entre les ions, provoquant par exemple, en présence d’une quantité importante d’ions Al, une diminution de l’absorption de K, Ca ou Mg.
5.5 Sols acides humides ou gleyifiés
5.5.1 Classification des sols
Dans un grand nombre d’érablières, surtout dans les Appalaches, des sols humides (drainage modéré à mauvais), caractérisés par des périodes d’anaérobioses plus ou moins prolongées, se développent fréquemment à côté des sols podzolisés mieux aérés. Ces sols sont généralement associés à une nappe phréatique élevée durant plusieurs mois de l’année, ou encore à une saturation temporaire au-dessus d’une couche relativement imperméable, comme par exemple dans le cas de sols minces sur roc. Un grand nombre de ces sols se retrouvent dans les petites dépressions (creux) comprises entre les bosses caractérisant le microrelief de la majorité des érablières. Bien que l’érable à sucre croisse généralement sur les sols bien aérés, souvent sur les bosses lorsque le microrelief est en bosses et creux, leurs racines peuvent explorer les sols humides des dépressions ou creux avoisinants. Dans les moraines des Appalaches, des brunisols dystriques ou sombriques gleyifiés (drainage modéré à imparfait), ou des gleysols humiques ou orthiques (drainage imparfait à mauvais), sont généralement observés à côté des sols podzolisés mieux aérés (figure 5.3). Dans les dépressions ou creux des dépôts riches en sable, principalement les sables fluvio-glaciaires et marins des basses terres du Saint-Laurent ou plusieurs dépôts morainiques des Laurentides, on retrouve des sols podzolisés constitués souvent de podzols ferro-humiques ou humiques gleyifiés, ou de brunisols sombriques gleyfiés (Pagé, 1987b).
Lorsque les dépressions ou creux occupent une surface importante du terrain, on observe dans les érablières à bouleau jaune, la présence du frêne noir, du sapin baumier ou de l’épinette blanche ou rouge.
5.5.2 Impact de l’anaérobiose périodique dans les sois humides sur la disponibilité des éléments nutritifs
Dans les sols des dépressions ou des creux, milieux faiblement aérés, les résidus organiques se décomposent lentement, pour donner des horizons holorganiques épais (figure 5.3). À moins de 50 cm de profondeur dans le sol, on distingue une matrice de faible saturation en couleur ou des marbrures avec forte saturation en couleur, dénotant l’oxydation localisée du Fe ferreux et la déposition d’oxydes ferriques hydratés.
D’une manière générale, les érables à sucre se développent sur la partie la mieux aérée du terrain, soit le plus souvent sur les bosses. Mais plus les dépressions ou les creux du microrelief occupent une surface importante, plus les érables explorent par leurs racines un volume important de sols humides. C’est pourquoi des arbres côte à côte peuvent se développer dans des conditions d’humidité différentes (figure 5.4). Les arbres se retrouvent en effet dans les milieux caractérisés par: 1- moins de 30 % de bosses (milieux humides à dominance de sols mal drainés); 2- entre 30 et 50 % de bosses (milieux faiblement aérés à dominance de sols imparfaitement drainés); 3- plus de 50 % de bosses (milieux aérés à dominance de sols bien drainés).
Figure 5.4 Représentation cartographique des milieux A (superficie des bosses < 30 %), B (superficie des bosses de 30 à 50 %) et C (superficie des bosses > 50 %) sur roche mère acide
On a constaté que dans les milieux humides à faiblement aérés, les érables ont souvent dans leurs feuilles une quantité moindre d’éléments minéraux que ceux des milieux pédologiques mieux aérés (Sauvesty et al., 1993). C’est également dans ces milieux qu’on a observé le plus grand nombre d’érables à sucre sévèrement atteints par le dépérissement. Or, les sols humides sont généralement plus riches en éléments nutritifs et moins acides que les sols aérés. On sait que l’anaérobiose liée au mauvais drainage entraîne une diminution du potentiel d’oxydo- réduction, lequel conduit à une diminution de la minéralisation de la matière organique. De tels milieux, par manque d’oxygène, provoquent un ralentissement de l’activité biologique, voire un changement dans le type de population microbienne qui peut passer d’aérobie à anaérobie. On comprend ainsi pourquoi les horizons Ah des sols humides ont une forte accumulation de matière organique humifiée. La disponibilité de certains éléments nutritifs, notamment de N et K peut être alors réduite. D’une part, la minéralisation de l’azote est ralentie (Duchaufour, 1977) et, d’autre part, le nitrate est rapidement réduit puis perdu dans le sol après conversion en oxyde nitreux ou en N 2 par dénitrification (Kozlowski et al., 199 1). Les éléments les plus solubles comme le potassium peuvent subir une dilution et être évacués dans la nappe d’eau (Duchaufour, 1977). Les conditions d’anaérobie ainsi que la saturation en eau du sol notamment au printemps, période d’activité métabolique importante pour les plantes, nuisent au métabolisme respiratoire des racines de l’érable; il y a compétition pour l’oxygène, entre la respiration radiculaire et celle des microorganismes du sol. La croissance des racines déjà existantes et la formation de nouvelles sont ainsi grandement réduites, voire même stoppées (Kozlowski, 1984; Kozlowski et Pallardy, 1984; Badibanga et al., 1992).
5.6 Sols faiblement acides et calcaires
5.6.1 Classification des sols
Dans les dépôts faiblement acides (pH 5,5 à 7,0) à calcaires (pH > 7,0), principalement retrouvés dans les basses terres du Saint-Laurent, les sols sont caractérisés par une forte activité biologique, notamment attribuable aux vers de terre. Ces dépôts sont constitués soit de moraines calcaires, soit de dépôts sédimentaires marins ou lacustres, soit d’alluvions récentes. Ces sols sont riches et fertiles et supportent de superbes érablières, dont la hauteur des arbres dépasse fréquemment les 30 m. D’une manière générale, les dépôts morainiques calcaires sont relativement filtrants et n’ont que rarement une couche imperméable limitant la pénétration de l’eau, comme c’est souvent le cas dans les moraines acides des Appalaches et des Laurentides. De ce fait, les caprices du microrelief en bosses et creux, fréquemment observé dans ce terrain, n’occasionnent que peu de différentiation quant au régime hydrique entre les sols des bosses et ceux des creux. Les sols des creux se distinguent alors des sols des bosses surtout par une plus grande épaisseur des horizons Ah. On reconnaît principalement dans ces milieux les érablières noires à caryer cordiforme et à tilleul d’Amérique (voir chapitre 4). On y retrouve surtout des brunisols mélaniques ou eutriques et, moins fréquemment, des gleysols humiques. Le brunisol mélanique (Ah>10 cm) ou eutrique (Ah<10 cm) est caractérisé par un horizon B (Bm) de couleur brune, à structure polyédrique bien développée (figure 5.3). La couleur brune est due à la présence de la matière organique et surtout à la forme du fer ferrique amorphe, en fines pellicules autour des colloïdes argileux. Soulignons le rôle important de l'activité microbienne, stimulée fortement par l'action des vers de terre, dans l'édification de ces horizons à taux de saturation élevé en bases, et à minéralisation rapide du carbone et de l'azote.
Si, d’une manière générale, les dépôts morainiques faiblement acides à calcaires sont relativement filtrants, il n’en est pas de même des dépôts sédimentaires fins, faiblement acides à calcaires. En effet, des gleysols humiques se développent fréquemment dans les dépressions ou les creux de ces dépôts. Lorsque ces dépressions ou creux deviennent importants, l’érable argenté ainsi que le frêne noir se développent préférentiellement. C’est dans ces milieux riches et plus humides que l’on a observé des érables à sucre en dépérissement.
5.7 Les formes d’humus
5.7.1 Moder
En fonction des conditions de température et d’humidité du milieu ainsi que de la nature de la roche-mère, les résidus de l’érablière qui tombent sur le sol subissent diverses transformations sous l’action de processus biologiques et biochimiques; ils contribuent ainsi à former les horizons de l’épisolum humifère, tels les horizons L, et en partie les horizons F, H et Ah, les racines y apportant également des quantités importantes de matière organique. Diverses formes d’humus sont ainsi développées. Dans les érablières à bouleau jaune et les érablières à hêtre, les sols acides et aérés sont généralement constitués d’humus de type moder (figure 5.3). Les moders se développent principalement grâce à l’action conjuguée de micro-organismes, de la mésofaune, tels myriapodes, larves d’insectes, collemboles, acariens et enchytraeïdes et de la macrofaune, tels isopodes, dyplopodes, mollusques, lombricides épigés et, en moindre importance, lombricides endogés. Des relevés préliminaires ont indiqué qu’il y avait environ 50 000 acariens par m2 et autant de collemboles et d’enchytraeïdes qui constituaient, à l’automne, une partie de la mésaufaune de l’érablière sur sols acides. Les vers de terre sont relativement disséminés dans ces sols (de 0 à 60 par m2) et contribuent faiblement aux transformations des résidus.
Les horizons L sont composés principalement de résidus végétaux relativement peu décomposés. On a observé que chaque horizon L (L1, L2 …, Ln) se superposant à la surface du sol, correspond généralement à la couche de feuilles tombées au cours d’une saison de croissance. Les critères permettant de séparer entre eux ces horizons sont la couleur des feuilles et l’importance de leur fragmentation, l’état de décomposition du limbe et des nervures et, enfin, l’accumulation entre chaque horizon de tissus ligneux plus difficilement dégradables, tels brindilles, pétioles, nervures, tiges de plantes de sous-bois (fougères, plantes éricacées, etc.), écailles de bourgeons et graines. Les horizons F sont composés de résidus en voie de décomposition, mais contiennent de 10 à 70 % de matière organique fine, matière dont on ne reconnaît plus les tissus d’origine. On a observé que dans les érablières, l’horizon F est constitué d’une grande abondance d’excréments de micro- arthropodes et de larves d’insectes. Dans les horizons H, plus de 70 % de la matière organique est fine et associée ou non à de l’argile, des limons ou des sables (17 % et plus de C organique). Enfin, les horizons Ah sont surtout constitués de matière organique fine associée à des argiles, des limons et des sables (< 17 % de C organique). On note une forte abondance d'excréments d'enchytraeïdes dans les horizons H et Ah des moders dans les érablières.
En résumé, dans les moders, la matière organique est décomposée sous l’action intense de la micro et mésofaune du sol (arthropodes, enchytraeïdes, etc.) et également par la macrofaune de surface; elle se présente fréquemment sous une forme floconneuse et de nombreux excréments sont souvent visibles sous la forme de fins granules cylindriques ou sphériques. La matière organique fine mélangée mécaniquement à la fraction inorganique par la faune du sol, ne constitue pas de véritables complexes argilo-humiques. On note également la présence de grains de quartz lavés.
5.7.2 Mor
L’humus mor est peu fréquent dans les érablières. On le retrouve dans certains sols humides ou très pauvres des érablières à bouleau jaune. Le rôle de la pédofaune dans l’humus mor est moins important que dans les moders. La formation des mors est principalement le résultat de l’action de l’activité microbienne, surtout celle des champignons. Cette forme d’humus se distingue donc par l’absence d’un horizon Ah lié à une activité de la mésofaune, comme c’est le cas des moders.
5.7.3 Mull
Dans les sols faiblement acides à calcaires (pH > 5,5), principalement dans les érablières noires et les érablières à tilleul ou à caryer, les vers de terre sont nombreux (> 400 par m2). Ils sont les principaux agents de transformation des résidus végétaux en un humus de type mull. Ils jouent par le fait même un rôle important dans le phénomène du recyclage des éléments nutritifs. Cet humus n’a généralement pas d’horizons F et H et est constitué d’un horizon L, formé presque uniquement de feuilles récentes et d’un horizon Ah (< 17 % de C organique) relativement épais (figure 5.3) et riche en éléments nutritifs. La matière organique fine est intimement mélangée à la fraction inorganique par les lombricides endogés et anéciques et, en moindre importance, par la micro et mésofaune du sol (arthropodes, enchytraeides) et par la macrofaune de surface, tels isopodes, dyplopodes, mollusques et lombricides épigés. Elle est présente sous la forme d'agrégats caractérisés par des complexes argilo-humiques, difficilement séparables mécaniquement.
5.8 Activité Biologique En Relation Avec La Fertilité Des Sols Des Erablières
Dans les érablières, l’activité biologique des sols est en relation avec la fertilité du sol. Il est possible de calculer un indice de décomposition des feuilles qui reflète cette activité. Cet indice est établi par l’équation suivante:
Idf = L2 + F dans laquelle,
L
Idf indice de décomposition des feuilles; L1 poids sec (g m-2 ) des feuilles récentes tombées sur le sol; L2 poids sec des feuilles tombées au cours des années antérieures; F poids sec de l’horizon F.
Plus le sol est riche et fertile, ou plus la saison de croissance est favorable à l’activité biologique, plus l’indice Idf est petit. Cet indice a donc été utilisé afin de connaître l’impact de la nature du sol, de la fertilisation ou du climat sur la qualité du milieu, laquelle est responsable de la croissance de l’érable à sucre. Les résultats obtenus indiquent que, dans les érablières du Québec, Idf est inférieur ou égal à 1 lorsque les résidus végétaux sont décomposés rapidement, en général en moins de deux ans. C’est le cas des sols d’érablières à mull développés sur roche-mère calcaire, dont la forte activité biologique est liée surtout aux micro-organismes et aux vers de terre. Lorsque Idf est compris entre 1 et 3, il caractérise des sols d’érablières de type moder, dont l’activité biologique modérée est liée principalement aux micro-organismes, aux micro-arthropodes et aux enchytraeïdes; la décomposition s’effectue habituellement en deux, trois ou quatre ans. Lorsque Idf est compris entre 3 et 7, il caractérise généralement les sols imparfaitement à mal drainés de type mor ou mull hydromorphe, retrouvés le plus souvent dans les dépressions ou creux des érablières dont l’activité biologique est faible ; la décomposition des feuilles est lente (plus de quatre ans). Enfin, lorsque Idf est supérieur à 7, il caractérise généralement les sols très mal drainés, dont la décomposition est très lente (souvent plus de dix ans). Ces sols se retrouvent dans les dépressions importantes des érablières. On a observé que pour des conditions édaphiques comparables, Idf d’érablières peu affectées par le dépérissement (taux de sévérité < 10 %) est inférieur d'une unité au moins à Idf d’érablières modérément affectées (taux de sévérité d’environ 25 à 5 0 %).
Dans la plupart des érablières, on observe entre 4 à 6 t ha-1 de résidus végétaux qui tombent annuellement sur le sol. Le paysage en bosses et creux précédemment décrit a une influence sur la répartition des résidus accumulés à la surface du sol. En effet, les éléments grossiers telles les brindilles ou les branches des arbres tombant sur le sol sont plus abondants dans les creux parce qu’ils y sont entraînés par gravité ou par l’action de l’eau superficielle ou des animaux fouisseurs. Il en est de même des feuilles, des graines, des fleurs et des écailles de bourgeons, mais le vent peut être alors un agent de transport important. Les résultats indiquent que plus les bosses sont étroites et élevées, moins la quantité de résidus foliaires qui s’y accumulent est importante; ainsi, les bosses étroites reçoivent souvent jusqu’à cinq fois moins de résidus que les creux. Il arrive même que les bosses soient entièrement dégarnies à la suite de vents violents ou de pluies torrentielles. C’est pourquoi les racines peuvent constituer la principale source de résidus végétaux au niveau de certaines bosses. Ces différences dans la répartition des résidus végétaux de même que dans la nature du sol font en sorte que, dans la plupart des érablières sur sols acides, on note une grande variation de l’activité biologique en relation avec le microrelief. On a ainsi observé dans les sols acides que l’indice Idf varie généralement de 1 à 3 au niveau des bosses, mais qu’il est supérieur à 3 au niveau des creux.
Bibliographie
Badibanga, B., F. Pagé, A. Sauvesty et C. Ansseau, 1992. Le système radiculaire dans les érablières du Québec. II. Le développement radiculaire en relation avec le microrelief et la roche-mère. Can. J. For. Res. (sous presse).
Brown, J.-L., 1977. Étude de la perturbation des horizons du sol par un arbre qui se renverse et de son impact sur la pédogénèse. Can. J. Soil Sci. 57: 173-186.
Brown, J. L., 1979. Étude systématique de la variabilité d’un sol podzolique, le long d’une tranchée dans une érablière à bouleau jaune. Can. J. Soil Sci. 59:131-146.
Brown, J.-L., 1981. Les forêts du Témiscamingue, Québec. Écologie et photo-interprétation. Lab. écologie for., Univ. Laval, Québec, 447 p.
Brown, J.-L., 1983. De la variabilité du sol. Sa nature, ses causes, son ampleur et ses conséquences pratiques. Univ. Laval, thèse Ph. D., 104 p.
Brown, J.L., 1987. Micro-relief, dynamique et évolution des sols au Québec méridional. Dans: Pagé, F. (éd.) La podzolisation des sols. Cahier de l’ACFAS n° 54: 91-104.
Brown, J.-L. et P. Gangloff, 1980. Géliformes et sols cryiques dans le sud de l’Abitibi, Québec. Géogr. phys. Quat., Vol XXXIV, n° 2, 137-158.
Brown, J.-L. et Y. Martel, 1981. Intérêt des chablis dans l’étude des paléosols. Géogr. phys. Quat. 35: 87-92.
Bruckert, S., 1979. Analyse des complexes organo-minéraux des sols. Dans: Bonneau, M. et S. Souchier (éd.). Pédologie, vol. 2. Masson, Paris, France, 459 p.
Bruckert, S. et M. Metche, 1972. Dynamique du fer et de l’aluminium en milieu podzolique: caractérisation des complexes organo-métalliques des horizons spodiques. Bull. ENSALA 14 (2):263-275. 1
Commission Canadienne de Pédologie, 1978. Le système canadien de classification des sols. Agric. Can., Ottawa, Ont., 170 p.
Dommergues, Y. et F. Mangenot, 1970. Le facteur eau. Dans: Écologie microbienne du sol. Masson, Paris, France, 393-425.
Duchaufour, Ph., 1977. Pédogenèse et classification. Vol. 1. Masson, Paris, France, 477 p.
Dwyer, L. M. et G. Merriam, 1981. Influence of topographic heterogeneity on deciduous litter decomposition. Oikos 37: 228-237.
Farmer, V.C., J. D. Russell et B. F. L. Smith, 1983. Extraction of inorganic forms of translocated AI, Fe and Si from a podzol Bs horizon. J. Soil Sci. 34: 571-576.
Giroux, M. et T. Sen Tran, 1985. Évaluation du phosphore assimilable des sols acides avec différentes méthodes d’extraction en relation avec le rendement de l’avoine et les propriétés du sol. Can. J. Soil Sci. 65:47-60.
Guillet, B. et B. Souchier, 1979. Les oxyhydroxydes amorphes et cristallins dans les sols (fer, aluminium, manganèse, silicium). Dans: Bonneau, M. et B. Souchier (éd.). Constituants et propriété du sol. Masson, Paris, France, 459 p.
Hart, G., R. E. Leonard et R. S. Pierce, 1962. Leaf fall, humus depth, and soil frost in a northern hardwood forest. Northeastern For. Exp. Sta., U. S. Dept. of Agriculture. For. res. note n° 131, 3 p.
Hendershot, W. H., 1990. Fertilization of sugar maple in the Quebec Appalachians. Fert. Res. (sous presse).
Hendershot, W. H. et A. R. C. Jones, 1989. The sugar maple dicline in Quebec: a discussion of possible causes and the use of fertilizers to lirnit damage. For. Chron. 65: 280-287.
Jeanroy, E., B. Guillet et R. Ortiz, 1984. Applications pédogénétiques de l’étude des formes du fer par les réactifs d’extraction: cas des sols brunifiés et podzolisés sur roches cristallines. Sci. Sol 3: 199-225.
Kozlowski, T. T., 1984. Responses of woody plants to, flooding. Dans: Kozlowski, T. T. (éd.).Flooding and plant growth. Academic Press, New York, 129-163.
Kozlowski, T. T., P. J. Kramer et S. G. Pallardy, 1991. Soil aeration, compaction, and flooding. Dans: Mooney, H. A. (éd.). The physiological ecology of woody plants. Academic Press, New York, 303-337.
Kozlowski, T. T., et S. G. Pallardy, 1984. Effects of flooding on water, carbohydrate and mineral relations. Dans: Kozlowski, T. T. (éd.). Flooding and plant growth. Academic Press, New York, 165-193.
Lachance, D., 1985. Répartition géographique et intensité du dépérissement de l’érable à sucre au Québec. Phytoprotection, 66: 83-90.
Laflamme, D., 1990. Déficiences minérales liées au dépérissement de l’érablière à bouleau jaune sur le bassin du lac Clair. MX Congrès, IUFRO, Montréal, Québec. Comptes rendus n° 2, 560 p.
McFee, W. W. et E. L. Stone, 1965. Quantity, distribution, and variability of organic matter and nutrients in a forest podzol in New York. Soil Sci. Soc. Amer. Proc. 30: 432-435.
McKeague, J. A., 1967. An evaluation of 0, 1M pyrophosphate and pyrophosphate-dithoinite in comparaison with oxalate as extractants of accumulation products in podzols and some other soils. Can. J. Soil Sci. 47: 95-99.
McKeague, J. A., J. E. Brydon et N. M. Miles, 1971. Differentiation of forms of extractable iron and aluminium in soils. Soil Sci. Soc. Amer. Proc. 35: 33-38.
Mehra, O.P. et M. L.Jackson, 1960. Iron oxides removal from soils and clays by a dithionite-citrate system buffered with sodium bicarbonate. 7th Nat. Conf. Clays Clay Min. 317-327.
Pagé, F., 1987 a. Fonctionnement actuel des sols podzolisés du Québec. Dans: Pagé, F. (éd.). La podzolisation des sols. Cahier de l’ACFAS n° 54: 6-40.
Pagé, F., 1987 b. Étude géochimique et micromorphologique des sols podzolisés du Québec. Genèse, fonctionnement et classification. Doctorat d’État. Univ. P. M. Curie, Paris, 349 p.
Pagé, F. et J. Berrier, 1983. Composition du matériel liant dans des horizons à ortstein, duriques, fragiques et cimentés intergrades du Québec. Can. J. Soil Sci. 63:435-463.
Pagé, F. et C. R. De Kimpe, 1987. Nature des composés ferrugineux et alumineux dans les horizons B podzoliques de sols du Québec en relation avec la présence de la nappe phréatique. Science du Sol, 25: 145-159.
Pagé, F. et C. IL De Kimpe, 1989. Dissolution des composés ferrugineux et alumineux dans les horizons B podzoliques de sols du Québec par le dithionite-citrate-bicarbonate, l’oxalate, le pyrophosphate et le tétraborate. Can. J. Soil Sci. 69: 451-459.
Pagé, F. et B. Guillet, 1991. Formation of loose and cemented B horizons in podzolic soils: evaluation of biological actions from micromorphological features, C/N values and 14C datings. Can. J. Soil Sci. 71: 485-494.
Pagé, F., A. Sauvesty, G. Roy, G. Gagnon et M. Giroux, 1992. Impacts des mauvaises saisons de croissance (1976-1986) sur le dépérissement des érablières des milieux pédologiques pauvres du Québec. Agrosol, 5: 5-9.
Paré, D. et B. Bernier, 1989. Origin of the phosphorus deficiency observed in declining sugar maple stands in the Quebec Appalachians. Can. J. For. Res. 19: 24-34
Richard, P., 1977. Végétation tardiglaciaire au Québec méridional et implications paléoclimatiques. Géogr. phys. Quat. 31: 161-176.
Richard, P., 1978. Histoire tardiglaciaire et post-glaciaire de la végétation au mont Shefford, Québec. Géogr. phys. Quat. 32: 81-93.
Robert, M., J. Berrier, G. Veneau et M. A. Vincente, 1981. Action of amorphous compounds on clay particle associations. 7 th Int. Clay Conf., Bologne. Abstr. p. 250.
Sauvesty, A., F. Pagé et M. Giroux, 1993. Impacts des milieux pédologiques en bosses et creux sur les teneurs en composés phénoliques et en éléments minéraux dans les feuilles d’érables à sucre (Acer saccharum) en dépérissement du Québec. Can. J. For. Res. 23: 190-198.
Tamm, O., 1922. Eine Methode sur Bestimmung der anorgischen Komponenten der Gelkomplexes im Boden. Medd. fr. Statens Skogforsokanstalt, 19: 307-404.
Turenne, J. F., 1975. Modes d’humification et différenciation podzolique dans deux toposéquences guyanaises. Thèse Doc. État, Univ. Nancy, 175 p.
6 Système radiculaire dans les écosystèmes d’érablière
Bady Badibanga, Fernand Pagé, Annie Sauvesty et Colette Ansseau
6.1 Introduction
L’érable à sucre (Acer saccharum Marsh.) se développe sur différents types de sols. Ainsi, dans les écosystèmes d’érablières du Québec, le microrelief en bosses et creux fait côtoyer, sur de courtes distances, les sols bien drainés des bosses avec les sols souvent imparfaitement à mal drainés des creux (voir chapitre 5). Il en résulte alors d’importantes variations dans les épaisseurs et les types d’horizons du sol et, en conséquence, dans le mode de prolifération des racines des arbres. Bien que les érables à sucre se développent surtout sur les bosses, leur système radiculaire se développe en relation avec la roche-mère sous-jacente (roche-mère acide ou roche-mère calcaire), le microrelief et la nature des sols qui leur sont associés (voir la section 1.5). De plus, les racines constituent par leur nature et leur taille, un facteur majeur qui détermine à la fois leur capacité à interagir avec des éléments chimiques du sol, à absorber certains de ceux-ci et à les transférer vers les parties épigées et, également, à servir de substrat à la pédofaune et à la microflore tellurique. Ce chapitre rend compte, en complément de la section 1.5, des caractéristiques majeures (morphologiques et biochimiques) des racines d’érable à sucre en relation avec les éléments précités.
6.2 Généralités
L’érable à sucre se développe sur différents types de sols allant des brunisols fertiles et bien drainés, aux podzols moins fertiles et même, dans certains cas, au gleysols imparfaitement à mal drainés. En ce qui concerne les milieux pédologiques des érablières sucrières du Québec, on note, d’une manière générale, qu’une roche-mère calcaire et filtrante favorise le développement d’un sol fertile, caractérisé par une activité biologique intense (présence de vers de terre), une capacité d’échange cationique élevée, une bonne capacité de rétention en eau, etc. À l’inverse, une roche-mère acide favorise le développement d’un sol moins fertile que le précédent, caractérisé par une activité biologique moins intense et une capacité d’échange cationique moins élevée. Enfin, la qualité du drainage déterminera, sur ces sites, la présence de sols aérés, faiblement aérés ou asphyxiants.
Étant donné que la première zone de contact entre le sol et l’érable à sucre est constituée par les racines, celles-ci forment, selon leur nombre et leur taille, un système radiculaire particulier qui permet non seulement le maintien de l’arbre au sol, mais également l’absorption de l’eau, la sélection des éléments nutritifs du sol, leur transfert dans les parties épigées de l’arbre et l’accumulation d’une partie importante des réserves.
Le système radiculaire est, de ce fait, le lien fondamental entre, d’une part, les contraintes environnementales qui déterminent la nature du sol et la disponibilité en éléments nutritifs et, d’autre part, les processus physiologiques qui incorporent ces éléments nutritifs dans le métabolisme général de l’arbre et dans ses organisations structurales.
Or, la nutrition de l’érable à sucre réfère non seulement à la disponibilité des éléments nutritifs dans le sol, mais également à la capacité de l’érable à sucre à les sélectionner, à les absorber et à les transférer vers les parties épigées. À ce niveau, les racines jouent un rôle primordial car elles constituent la zone de passage de la quasi- totalité de l’eau et des éléments minéraux (Callot et al., 1982).
Toutefois, ce passage sera d’autant plus aisé que la taille de la racine sera petite. En effet, même si toutes les racines, quel que soit leur âge, peuvent absorber les éléments nutritifs (Van Praag et al., 1988; Atkinson, 1985), la région maximale d’absorption se situerait dans la zone de maturation des vaisseaux du xylème, c’est-à-dire dans les tissus âgés de deux à trois jours seulement (Clarkson et Robards, 1975). Comme la maturation des radicelles s’accompagne généralement d’une subérisation, voire d’une lignification des cellules du phellème et du périderme, il s’y développe alors un frein non négligeable au passage des éléments absorbés vers le xylème (Chung et Kramer, 1975; Drew, 1979). Ce sont donc les radicelles les plus jeunes et partant les plus fines, qui auraient le potentiel d’absorption le plus élevé. Plusieurs aspects de la fonction radiculaire dépendent donc de la taille des racines et, dans le cas précis de la fonction d’absorption, de la taille de la radicelle et/ou de son appartenance à une classe de diamètre donnée.
S’il est vrai que les caractéristiques du système radiculaire de l’érable à sucre dépendent en partie de sa génétique et en partie des conditions qui prévalent dans son environnement pédologique, il est également vrai que le système radiculaire, en général – et les radicelles en particulier – modifient en retour leur environnement et jouent un rôle non négligeable dans la formation et l’évolution des milieux pédologiques, notamment des horizons du sol qu’ils explorent de façon préférentielle.
Dans ce sens, la présence plus ou moins abondante de radicelles d’une classe de diamètre donnée dans un horizon du sol serait indicatrice du rôle joué par ces radicelles dans l’édification et le maintien de cet horizon, en raison notamment de l’apport de quantités appréciables de matière organique (produit de leur recyclage assez rapide), de l’apport de diverses substances chimiques et de métabolites (produits de l’exsudation), de la création d’une multitude de canaux qui favorisent l’aération, le drainage et la capacité de rétention en eau et, enfin, en raison du fait que les radicelles servent de substrat aux organismes et micro-organismes du sol.
Compte tenu de ce qui précède, l’érable à sucre devra, pour survivre et se développer, pour s’adapter à son environnement et croître de façon optimale, développer des stratégies d’acquisition, d’utilisation et d’accumulation des ressources disponibles. En effet, le microrelief caractéristique des érablières sucrières du Québec et la variété des sols qui en découle créent des milieux pédologiques dans lesquels prévalent des conditions particulières qui accentuent, sur un même site, les déséquilibres dans la disponibilité des ressources. L’allocation des ressources étant basée sur la relation qui existe entre l’état phytosanitaire de l’arbre et l’allocation de quelques ressources considérées comme essentielles (Abrahamson et Caswell, 1982), l’érable à sucre aura tendance à répondre de façon homéostatique à ces déséquilibres en ressources, notamment en allouant une biomasse additionnelle aux organes responsables de l’acquisition des ressources qui limitent le plus sévèrement sa croissance (Chapin et al., 1987; Bloom et al., 1985; Mooney, 1972). Ainsi, l’allocation de la biomasse à divers organes peut être considérée comme le reflet de l’allocation de ressources limitées (Bazzaz et al., 1987; Abrahamson, 1979). Dans le cas précis de l’érable à sucre, ceci implique une gestion différentielle des ressources disponibles en fonction de la croissance et de la prolifération de ses racines dans les divers types de sol et dans leurs horizons caractéristiques (Badibanga et al., 1992a; Gleeson et Tilman, 1990).
Dans les érablières en dépérissement, l’existence généralement admise d’un problème de nutrition minérale (Sauvesty et al., 1989; Schulze, 1989; Hendershot, 1988; Bernier et Brazeau, 1988; Carroll et al., 1982), incite plusieurs chercheurs à dire que le processus de dépérissement se manifesterait d’abord au niveau des racines, la plupart des autres symptômes ne faisant que traduire l’état de détérioration du système radiculaire (Bauce et Allen, 1992; Bauce, 1989; Garrec, 1989; Wargo, 1983; Carroll et al., 1982; Lortie, 1966; Pomerleau et Lortie, 1962). Il existerait ainsi une relation étroite entre l’état de détérioration du système radiculaire et celui de la cime (Dessureault, 1985).
Compte tenu de l’importance de l’érable à sucre tant du point de vue écologique qu’économique, il est donc très important de bien caractériser son système radiculaire étant donné que celui-ci joue un rôle prépondérant dans le support, la croissance et la survie de l’arbre en général.
Les résultats fournis dans ce chapitre ont été tirés d’études menées essentiellement dans des érablières des Appalaches (comté d’Arthabaska) et de la région de Montréal (comté de Terrebonne). Dans les érablières considérées, et qui se retrouvent sur de grandes superficies dans les régions précitées, la nature de la roche-mère détermine la présence de sols fertiles (roche-mère calcaire) ou de sols moins fertiles (roche-mère acide) alors que le microrelief (en bosses et creux) détermine, en fonction du drainage, la présence de milieux péologiques aérés, faiblement aérés ou asphyxiants. 1
6.3 Masse des radicelles d’érables à sucre
6.3.1 Masse totale des radicelles
Les études menées dans des érablières sucrières se développant sur les deux types de roche-mère précités, ont permis d’évaluer l’importance de la masse (t) des radicelles (racines < 2 mm) d'érable à sucre sur un hectare de terrain pour des' sites comportant en moyenne 65 % de bosses et 35 % de creux (Badibanga, 1994; Sauvesty et al., 1993; Badibanga et al., 1992a). D'une manière générale, les érables à sucre produisent plus de radicelles sur roche- mère calcaire (19,4 t ha-1) que sur roche-mère acide (16,1 t ha-1) (figure 6.1A). Si l'on considère uniquement le microrelief, on note que, quel que soit le site, la masse de radicelles est beaucoup plus élevée sur les bosses (14-17 t ha-1) que dans les creux (2-4 t ha-1) (figure 6. 1 B). Il apparaît donc que les sols les plus riches en éléments nutritifs (brunisols sur roche-mère calcaire) ont tendance à favoriser davantage le développement des radicelles.
Figure 6.1 Masse totale approximative des radicelles en relation avec la nature de la roche-mère et le microrelief. (Source: Badibanga et al., 1992a).
6.3.2 Distribution verticale de la masse des radicelles en relation avec la roche-mère et le microrelief
L’étude de la distribution verticale de la masse des radicelles montre que la répartition de la masse totale des radicelles dans les différents horizons du sol est influencée par la présence et l’alternance de bosses et de creux dans le paysage (Tableau 6.1). Ainsi, dans les creux, les conditions d’humidité et d’anaérobiose périodique qui prévalent tendent à limiter le développement du système radiculaire. Celui-ci s’effectue alors et surtout dans les horizons de surface F et Ah, mieux aérés. Sur les bosses, on note, sur roche-mère acide, une masse élevée de radicelles dans les horizons B. Ceci serait le reflet de conditions physico-chimiques plus favorables au développement des radicelles, notamment une meilleure disponibilité des éléments nutritifs, une activité biologique élevée et une structure granulaire généralement bien développée jusqu’à plus de 60 cm de profondeur.
Tableau 6.1 Masse relative des radicelles dans les sols des sites sur roche-mère acide et sur roche-mère calcaire.
Note: Ml, pourcentage du poids total moyen des radicelles de l’horizon par centimètre carré; M2, pourcentage du poids total moyen des radicelles du profil par centimètre carré; B, tous les horizons B du profil; D, classe de diamètre des radicelles en millimètres.
La figure 6.2 montre la densité moyenne des radicelles sur les bosses et dans les creux des sites sur roche-mère acide et sur roche-mère calcaire.
Figures 6.2 A et B Densités moyennes des radicelles à la rupture de pente des bosses (A) et au centre des creux (B) dans les sites sur rochemère acide et roche-mère calcaire (Source: Badibanga et al., 1992a)
Sur les bosses des érablières sur roche-mère acide, 80 % en moyenne des radicelles sont observées dans les horizons B (tableau 6.1) (figure 6.2A). On retrouve cependant une densité plus élevée de radicelles de diamètre < 0,5 mm dans les horizons F et Ah que dans les horizons B. Dans l'horizon F, les radicelles de diamètre < 0,5 mm constituent 91 % des radicelles. On note également que c'est surtout dans ce dernier horizon que se développe un grand nombre de radicelles de diamètre < 0,3 mm (43 %). Une telle prolifération de radicelles dans les horizons F et Ah semble être le résultat de la présence de quantités plus élevées d'éléments nutritifs dans ces horizons de surface. Par ailleurs, la faible densité apparente de ces horizons facilite la pénétration et le développement de radicelles de diamètre < 0,5 mm peu subérisées, donc peu fermes, créant ainsi la structure enchevêtrée caractéristique de la morphologie des radicelles présentes dans ces horizons du sol. La figure 6.2A montre également qu'il existe fréquemment un réseau dense de radicelles au contact de l'horizon BC avec l'horizon Cxgj, horizon fragique dont la dureté empêche la pénétration des racines.
Dans les creux, sur roche-mère acide, le mauvais drainage des sols limite la pénétration en profondeur des racines. Le développement du système radiculaire s’effectue donc surtout dans les horizons de surface mieux aérés. En effet, plus de 60 % des radicelles sont observées dans les horizons F et Ah (tableau 6.1).
De façon générale, on observe que sur roche-mère acide, la pénétration en profondeur des racines des érables à sucre se fait jusqu’à une profondeur maximale de 50 cm sur les bosses, tandis que dans les creux, cette pénétration se limite à environ 20 cm (figures 6.2A et 6.2B).
Sur roche-mère calcaire, il y a absence d’horizon F. On observe, dans les horizons B et BC des bosses, des proportions élevées de radicelles de diamètre 1,0-2,0 mm (tableau 6.1 et figure 6.2A).
Dans les creux, 92 % des radicelles se trouvent dans l’horizon Ah dont l’épaisseur varie entre 15 et 20 cm. Dans cet horizon, la grande majorité des radicelles ont un diamètre de 0,3-0,5 mm.
Sur roche-mère calcaire, l’érable à sucre produit une masse totale de radicelles plus importante, mais une densité moindre de radicelles de diamètre < 0,3 mm que sur roche-mère acide. Les radicelles y sont donc plus grossières, courtes, moins enchevêtrées et réparties de façon plus uniforme dans tout le profil.
En conclusion, on note que, selon la nature de la roche-mère, l’érable à sucre produit une masse de radicelles différente et répartie aussi de façon différente à travers les divers horizons du sol. Ainsi, sur roche-mère acide, l’érable à sucre produit des radicelles très fines et très denses dans les horizons de surface (F, Ah et les premiers centimètres de l’horizon B). Sur roche-mère calcaire par contre, l’érable à sucre produit une densité moindre de radicelles de diamètre < 0,3 mm même si au total, la masse de radicelles est y est plus importante que sur roche-mère acide. Finalement, il a été observé que plus un terrain est caractérisé par une proportion élevée de creux et par le fait même de sols imparfaitement à mal drainés, moins le volume d'exploration des racines sera important.
6.4 Caractérisations biochimiques
Des analyses biochimiques effectuées sur les radicelles d’érable à sucre ont permis de déterminer les teneurs de celles-ci en éléments minéraux majeurs, en composés phénoliques et en amidon, le tout en relation avec les différents milieux pédologiques considérés et les différentes classes de diamètre retenues (Badibanga, 1994).
Teneurs en éléments minéraux majeurs des radicelles
La figure 6.3A montre les variations des teneurs en azote des radicelles d’érable à sucre. On note des teneurs en azote plus élevées surtout dans les classes de diamètre de radicelles > 0, 5 mm du milieu pédologique sur roche- mère calcaire.
Figure 6.3 Teneurs en azote (N) et en phosphore (P) des radicelles d’érable à sucre en relation avec les milieux pédologiques et les classes de diamètre (Source: Badibanga, 1994)
La figure 6.3B montre que, quel que soit le milieu pédologique considéré, les teneurs en phosphore des radicelles d’érable à sucre sont plus basses dans la classe de diamètre > 0,3 mm et la classe de diamètre <2 mm. C'est cependant dans le milieu pédologique sur roche-mère calcaire que l'on retrouve les valeurs les plus élevées.
La figure 6.4A montre les variations des teneurs en potassium dans les milieux pédologiques considérés. On observe une diminution de teneur en potassium dans les radicelles des milieux pédologiques calcaires aux milieux pédologiques acides, puis aux milieux pédologiques humides. On note également que les teneurs sont significativement plus élevées dans les radicelles < 0,3 mm.
Figure 6.4 Teneurs en potassium (K) et magnésium (Mg) des radicelles d’érable à sucre en relation avec les milieux pédologiques et les classes de diamètre (Source: Badibanga, 1994)
Il est à noter que le potassium étant un élément très hydrosoluble, il peut être plus facilement perdu par lessivage dans les milieux pédologiques humides, ce qui expliquerait, du moins en partie, les teneurs en potassium moins élevées observées dans les radicelles en milieu pédologique humide sur roche-mère acide.
La figure 6.4B montre que les variations dans les teneurs en magnésium des radicelles en fonction des diverses classes de diamètre s’effectuent suivant le même modèle dans chacun des milieux pédologiques considérés. On observe donc que les radicelles d’érable à sucre se développant dans le milieu pédologique sur roche-mère calcaire, ont des teneurs en magnésium significativement plus élevées que celles des radicelles d’érable à sucre se développant dans les milieux pédologiques sur roche-mère acide. On observe également, dans les trois milieux pédologiques, une diminution des teneurs en magnésium entre les radicelles de la classe de diamètre < 0,3 mm et les autres classes de diamètre.
La figure 6.5 montre que les variations des teneurs en calcium dans les diverses classes de diamètre se fait selon le même modèle dans les trois milieux pédologiques. Toutefois, on observe que les radicelles d’érable à sucre se développant en milieu pédologique sur roche-mère calcaire ont les teneurs les plus élevées en calcium et ce, quelle que soit la classe de diamètre. Quel que soit le milieu pédologique, on observe que les radicelles les plus fines ont les teneurs en calcium les plus faibles et que les teneurs en calcium augmentent avec une augmentation de la taille des radicelles, pour atteindre un maximun dans les radicelles, de la classe de diamètre 1,0-2,0 mm. Des différences significatives des teneurs en calcium des radicelles d’érable à sucre ont donc été observées en fonction de la nature de la roche-mère dans les radicelles les plus grossières, soit les radicelles de classes de diamètre 0,5-1,0 mm, 1,0-2,0 mm et 2,0-5,0 mm.
Figure 6.5 Teneurs en calcium (Ca) des radicelles d’érable à sucre en relation avec les milieux pédologiques et les classes de diamètre (Source: Badibanga, 1994)
Il est à noter également que sur roche-mère acide, il n’existe pas de différence significative entre le milieu pédologique aéré et le milieu pédologique humide.
Sachant que le calcium est un constituant majeur de la paroi cellulaire, on le retrouve en de plus grandes teneurs dans les radicelles qui ont les parois cellulaires les plus épaisses. Toutefois, les radicelles de diamètre > 2,0 mm sont subérisées et ont une forte tendance à la lignification. Il est donc fort probable que le calcium des parois cellulaires de ces radicelles soit remplacé par la lignine et la subérine, d’où la diminution prononcée des teneurs en calcium dans les radicelles de cette classe de diamètre.
La comparaison des moyennes des milieux pédologiques pour chaque classe de diamètre montre que, pour les éléments minéraux majeurs suivants: azote, phosphore, potassium et magnésium, il existe des différences significatives entre les trois milieux pédologiques (SS, T2 et T3) seulement dans la classe de diamètre < 0,3 mm. Pour les autres classes de diamètre, il existe des différences statistiquement observables en relation avec la nature de la rochemère, les radicelles d'érable à sucre se développant en milieu pédologique sur roche-mère calcaire ayant des teneurs en éléments minéraux plus élevées que celles des radicelles d'érable à sucre se développant en milieux pédologiques sur roche-mère acide. Sur roche-mère acide, il n'y a pas de différence significative entre le milieu pédologique aéré et le milieu pédologique humide.
Les radicelles de classe de diamètre < 0,3 mm sont constituées, en grande partie, de cellules aux parois très minces et non subérisées. Il en résulte une très bonne perméabilité membranaire qui leur confère une capacité d'absorption très élevée et, souvent, une accumulation plus abondante en éléments minéraux. À l'inverse, les radicelles de classes de diamètre comprises entre 0,3 et 5,0 mm sont plus âgées, ont des parois cellulaires plus épaisses, tendent davantage à la subérisation, à la lignification et même à un épaississement secondaire du xylème. Ceci affecte la perméabilité des membranes cellulaires, laquelle tend à diminuer.
Ceci explique, en partie, le fait que pour le calcium, les teneurs soient plus élevées dans les radicelles les plus grossières, c’est-à-dire celles des classes de diamètre comprises entre 0,5-1,0 mm et 2,0-5,0 mm et que ce soit dans ces classes de diamètre que l’on note, pour cet élément, les différences significatives. Ces différences existent en relation avec la nature de la roche-mère, les radicelles d’érable à sucre se développant en milieu pédologique sur roche-mère calcaire ayant des teneurs en calcium statistiquement plus élevées que celles des radicelles d’érable à sucre se développant en milieux pédologiques sur rochemère acide.
Teneurs en composés phénoliques des radicelles
La figure 6.6 montre que, quel que soit le milieu pédologique considéré, le schéma de variation des teneurs en composés phénoliques selon les diverses classes de diamètre demeure le même, les radicelles de diamètre < 0,3 mm et celles de diamètre 2,0-5,0 mm ayant les teneurs en composés phénoliques les plus basses, alors que les radicelles de diamètre 0,3-0,5 mm ont les teneurs en composés phénoliques les plus élevées.
Figure 6.6 Teneurs en composés phénoliques des radicelles d’érable à sucre en relation avec les milieux pédologiques et les classes de diamètre.
Le seul élément de. différence entre les milieux pédologiques est relié aux niveaux des teneurs en composés phénoliques dans les radicelles, le milieu pédologique sur roche-mère calcaire étant celui qui montre les niveaux les plus élevés. La figure 6.7 montre également que, dans les trois dernières classes de diamètre (diamètre compris entre 0,5 et 5,0 mm), les teneurs en composés phénoliques diminuent avec une augmentation de la taille des radicelles.
Figure 6.7 Teneurs en amidon des radicelles d’érable à sucre en relation avec les milieux pédologiques et les classes de diamètre (Source: Badibanga, 1994)
Les résultats indiquent que les seules différences significatives dans les teneurs en composés phénoliques des radicelles se trouvent chez les radicelles de classes de diamètre 0,5-1,0 mm et 1,0-2,0 mm. Dans ces classes, on note en effet que les radicelles d’érable à sucre se développant en milieu pédologique sur roche-mère calcaire ont des teneurs en composés phénoliques statistiquement plus élevées que celles des radicelles d’érable à sucre se développant en milieux pédologiques sur roche-mère acide. Ainsi, dans nos conditions expérimentales, c’est donc davantage la nature de la roche-mère que le type de drainage qui influence les teneurs en composés phénoliques des radicelles d’érable à sucre.
Sauvesty et al. (1991, 1993) soulignent, en ce qui concerne les feuilles d’érable à sucre se développant dans les milieux pédologiques sur roche-mère acide, que la forte production de composés phénoliques observée dans celles-ci serait induite conséquemment à un état de stress chez les arbres.
Les teneurs en composés phénoliques les plus élevées sont donc observées dans le milieu pédologique où prévalent des conditions défavorables à la croissance de l’érable à sucre, soit celles des milieux pédologiques humides. Dans ces milieux, l’évaluation de la sévérité du dépérissement, exprimée en terme de pourcentage de feuillage manquant, de branches mortes, de décollement de l’écorce, etc., indique qu’il existe une relation significative entre les conditions d’humidité du milieu pédologique et l’ampleur du phénomène (Sauvesty et al., 1993). Or, nos recherches montrent que, en ce qui concerne les radicelles, les teneurs en composés phénoliques les plus élevées sont observées dans les radicelles d’érable à sucre se développant dans le milieu pédologique sur rochemère calcaire, milieu fertile et bien drainé, où prévalent les conditions les plus favorables à la croissance de cette espèce.
Il est donc fort probable que les composés phénoliques présents dans les radicelles d’érable à sucre ne soient pas, comme c’est le cas dans les feuilles, des métabolites indicateurs de stress. Dès lors, ces composés phénoliques seraient produits et utilisés à d’autres fins, notamment pour la fabrication de la lignine, du matériel pariétal, des pigments, etc. Ils seraient donc des composés phénoliques constitutifs, c’est-à-dire ceux que l’arbre produit en tout temps et utilise à d’autres fins que la défense.
Nous avons en effet observé une diminution des teneurs en composés phénoliques à partir de la classe de diamètre 0,5-1,0 mm, diminution qui atteint son niveau le plus bas dans les radicelles de la classe de diamètre 2,0-5,0 mm, niveau comparable à celui observé dans les radicelles les plus petites, c’est-à-dire celles de la classe de diamètre < 0,3 mm. On peut donc supposer que dans les radicelles appartenant à la classe de diamètre 2,0-5,0 mm, le processus de lignification est tel que les précurseurs de la lignine ne peuvent plus figurer sous forme de composés phénoliques. Toutefois, ce qui est certain, c'est qu'un état de stress ne se traduit pas, chez l'érable à sucre, de la même façon dans les feuilles que dans les radicelles (figure 6.3A).
Teneurs en amidon des radicelles d’érable à sucre
La figure 6.7 montre que c’est dans les trois dernières classes de diamètre que l’on observe les écarts les plus marquants entre, d’une part, les teneurs en amidon des radicelles d’érable à sucre se développant dans les milieux pédologiques sur roche-mère acide et celles d’érable à sucre se développant dans le milieu pédologique sur roche-mère calcaire et, d’autre part, entre les teneurs en amidon des radicelles d’érable à sucre se développant dans le milieu pédologique aéré sur roche-mère acide et celles d’érable à sucre se développant dans le millieu pédologique humide sur roche-mère acide. Ces écarts tendent d’ailleurs à s’amplifier avec l’augmentation en diamètre des radicelles. Enfin, on note que les radicelles de la classe de diamètre 2,0-5,0 mm ont, en moyenne, des teneurs en amidon quatre fois plus élevées que celles des radicelles de la classe de diamètre < 0,3 mm et ce, quel que soit le milieu pédologique considéré. Les résultats indiquent que c'est dans cette classe de diamètre que se situe la seule différence statistiquement observable entre les trois milieux pédologiques en ce qui concerne les teneurs en amidon des radicelles d'érable à sucre. On note donc qu'en moyenne les radicelles de cette classe de diamètre se développant dans le milieu pédologique humide sur roche-mère acide ont des teneurs en amidon plus élevées que celles d'érable à sucre se développant dans le milieu pédologique aéré sur roche-mère acide et plus élevées que celles d'érable à sucre se développant dans le milieu pédologique sur roche-mère calcaire.
Ainsi, les érables à sucre qui se développent dans le milieu où prévalent les conditons pédologiques les plus défavorables à leur croissance (milieu pédologique humide sur roche-mère acide) accumulent plus de réserves (sous forme d’amidon) dans leurs radicelles grossières que les érables à sucre qui se développent dans les milieux où les conditions pédologiques sont plus favorables à leur croissance (milieux pédologiques aérés). La différence est d’autant plus remarquable que le milieu est fertile (milieu pédologique sur rochemère calcaire).
Les radicelles grossières (> 2,0 mm) sont plus subérisées et tendent à se lignifier, ce qui leur donne une longévité plus grande comparativement aux radicelles de taille inférieure qui sont plus sensibles aux fluctuations des conditions du milieu, donc à une mortalité précoce. De plus, l’amidon s’accumulant surtout dans les cellules du parenchyme du xylème (parenchyme de rayon près du cambium) (Kramer et Kozlowski, 1979), on retrouve davantage cette structure bien développée (épaississement secondaire) dans les radicelles les plus grossières. Nos résultats confirment donc ceux de Nguyen et al. (1990), Pregitzer et al. (1990) et Wargo (1983) qui estiment que l’érable à sucre accumule la plus grande proportion de ses réserves dans les racines grossières.
6.5 Discussion générale
Les études que nous avons menées montrent que, dans les érablières sucrières des Appalaches et de la plaine du Saint-Laurent, les conditions qui prévalent dans le milieu pédologique influencent de façon prépondérante la gestion, par l’érable à sucre, de son système radiculaire et plus particulièrement de ses radicelles.
En effet, Bloom et al. (1985) et Mooney (1972) mentionnent que les plantes tendent à répondre de façon homéostatique aux déséquilibres en ressources en allouant une biomasse nouvelle à des fins d’acquisition des ressources qui limitent le plus sévèrement leur croissance. Ainsi, dans les milieux pédologiques où prévalent des conditions défavorables à sa croissance (milieux peu fertiles sur roche-mère acide), l’érable à sucre utilise de façon préférentielle un mode d’allocation des ressources qui privilégie la production de radicelles très fines, très longues et concentrées dans les horizons de surface, ceci au détriment de radicelles grossières et courtes qui ont tendance à se développer plus en profondeur.
Les radicelles très fines (diamètre < 0,3 mm) étant formées de cellules aux parois cellulaires très minces et non subérisées possèdent, de ce fait, une bonne perméabilité membranaire et partant, une capacité d'absorption élevée. De plus, leur longueur et leur enchevêtrement leur permettent d'explorer le maximun de volume de sol disponible. Étant donné que le mauvais drainage crée, dans les milieux pédologiques humides sur roche-mère acide, des conditions d'anaérobiose périodique qui d'une part, limitent la croissance en profondeur des radicelles et, d'autre part, permettent le développement d'un milieu de fermentation dans lequel prolifèrent les micro-organismes anaérobies (levures, champignons, etc.), les radicelles produites dans ces milieux pédologiques vont donc se concentrer dans les horizons de surface F et Ah mieux aérés. Or, Paré et Bernier (1989) ont montré que les radicelles localisées dans les horizons de surface jouent un rôle important dans l'absorption des éléments nutritifs, plus particulièrement dans celle du phosphore. Aussi, cette concentration élevée près de la surface du sol permettra à l'érable à sucre de profiter au maximum des nutriments libérés lors de la fermentation des résidus végétaux, avant que ceux-ci ne soient entraînés en profondeur, hors de la rhizosphère. Ceci expliquerait davantage la présence de teneurs en éléments minéraux plus élevées dans ces radicelles, sauf pour le calcium.
Dans le cas du calcium, il est un constituant majeur de la paroi cellulaire et plus particulièrement de la lamelle moyenne (Kramer et Kozlowski, 1979). On le retrouvera donc en de plus grandes quantités dans les radicelles plus grossières, c’est-à-dire celles qui ont des parois cellulaires plus épaisses. Toutefois, lorsque la radicelle atteint une taille > 2,0 mm, les teneurs en calcium atteignent des valeurs minimales, presque semblables à celles des radicelles les plus fines (diamètre < 0,3 mm). En même temps, on note une diminution des teneurs en composés phénoliques dans ces radicelles de diamètre > 2,0 mm. Une telle diminution des teneurs en composés phénoliques correspondrait à une lignification des radicelles de cette taille, les composés phénoliques ayant servi à la production de la lignine. Dans les radicelles de cette taille, la lignine deviendrait donc le constituant majeur des cellules et ce, au détriment du calcium.
Dans les milieux pédologiques humides sur roche-mère acide, l’alternance de périodes d’humectation et de dessication durant la saison de croissance fait subir aux radicelles de fréquents stress (sécheresse, gel précoce ou tardif, etc.) qui les rendent très vulnérables à l’invasion par la microflore tellurique et causent, par mortalité, des pertes importantes de radicelles. Toutefois, ces pertes peuvent être compensées par la vitesse de renouvellement également élevée de cette catégorie de radicelles, laquelle varie de quelques jours à quelques semaines (Harris et al., 1980; Persson, 1978, 1980). Ce renouvellement des radicelles engendre pour l’arbre un coût substantiel en carbone et autres intrants (Chapin et al., 1987; Lambers et al., 1983; Orians et Solbrig, 1977).
D’autre part, ces milieux humides seraient caractérisés par une diminution de la disponibilité en éléments minéraux, notamment en azote et en phosphore (Sauvesty al et., 1989, 1992, 1993). Selon ces auteurs, les conditions d’anaérobiose périodique qui prévalent dans ces milieux entraînent une diminution du potentiel d’oxydo-réduction, lequel conduit, entre autres, à une diminution de la minéralisation de l’azote et à une réduction rapide du nitrate qui est alors perdu dans le sol après conversion en oxyde nitreux ou en nitrite par dénitrification. La littérature s’accorde également pour dire que les conditions asphyxiantes subséquentes à un mauvais drainage du sol créent non seulement une compétition entre les radicelles et les micro-organismes du sol pour l’acquisition de l’azote (ce qui entraîne une diminution, dans le milieu, de la quantité d’azote absorbable par les radicelles), mais contribuent également à la diminution de la perméabilité membranaire des cellules des radicelles, ce qui occasionnerait un lessivage des éléments au détriment de leur absorption.
Sauvesty et al. (1993) notent que, même si les sols en milieu pédologique humide sur roche-mère acide sont caractérisés par une abondance en certains éléments minéraux, notamment en potassium, leur disponibilité est réduite par les conditions du milieu. Dès lors, les éléments les plus solubles comme le potassium peuvent subir un lessivage ou être évacués par les eaux de ruissellement. Les mêmes auteurs ont vérifié, sur une échelle régionale, que dans ces milieux pédologiques humides, tous les érables à sucre sont atteints par le processus de dépérissement et que, parmi ceux-ci, 30 % sont très atteints (sévérité de dépérissement > 25 %). À l’inverse, en milieux pédologiques aérés, 66 % des érables à sucre sont sains et aucun n’est très atteint par le dépérissement. Ils en concluent donc que plus les conditions d’humidité sont mauvaises, plus le nombre d’érables à sucre sévèrement atteints par le dépérissement est élevé.
La saturation périodique en eau qui prévaut dans les milieux pédologiques humides engendre une compétition pour l’oxygène entre la respiration radiculaire et celle des micro-organismes du sol. Les perturbations métaboliques subséquentes contribueraient alors à une diminution du métabolisme respiratoire du système radiculaire, ce qui induirait, entre autres, une détérioration de l’état phytosanitaire de l’arbre ainsi qu’une accumulation plus accrue d’amidon dans les radicelles, notamment dans les radicelles grossières (classe de diamètre 2,0-5,0 mm). Axelsson et Axelsson (1986) ainsi que McDonald et al. (1986) ont également montré, pour d’autres espèces (épinette et bouleau), que l’accumulation de réserves était plus élevée dans les sites les moins fertiles et les plus stressants pour ces arbres.
Nos résultats montrent que l’érable à sucre produit, dans le milieu pédologique humide sur roche-mère acide, une plus grande quantité de radicelles très fines (classe de diamètre < 0,3 mm). Ces radicelles sont formées surtout à partir de radicelles de la classe de diamètre 2,0-5,0 mm, voire de la classe de diamètre 2,0-8,0 mm. Or, ces radicelles ont un épaississement secondaire du xylème qui tend à remplir tout l'espace interne de la radicelle. Comme l'arbre accumule ses réserves dans les cellules du parenchyme de rayon du xylème, ceci expliquerait davantage l'accumulation plus élevée d'amidon dans les radicelles de la classe de diamètre 2,0-5,0 mm car, d'une part, dans les milieux stressants pour l'arbre, les réserves ont tendance à s'accumuler près des sites d'utilisation, notamment dans les feuilles ou encore dans les radicelles de la classe de diamètre 2,0-5,0 mm et, d'autre part, ces radicelles offrent un espace d'emmagasinage plus important. Ces radicelles étant le plus souvent lignifiées, ceci leur confère une meilleure résistance face aux multiples stress qui peuvent survenir dans ces milieux défavorables et également face à une biodégradation éventuelle. Les réserves sont non seulement accumulées dans un endroit où elles sont facilement et rapidement disponibles, mais aussi dans un endroit sécuritaire pour leur survie.
Dans les milieux stressants, on a donc tendance à observer une retranslocation différentielle d’énergie entre les radicelles de classe de diamètre 2,0-5,0 mm et les radicelles des classes de diamètre inférieures, ceci aux dépens des radicelles plus grossières. Ainsi, l’amidon accumulé à l’automne dans les radicelles de classe de diamètre 2,0-5,0 mm fournirait, suite à sa dégradation, l’énergie nécessaire à la production de nouvelles radicelles au printemps (Yin et al., 1989; Philipson, 1988; McLaughlin et al., 1980; Wargo, 1979). Dans le milieu fertile (milieu pédologique sur roche-mère calcaire), l’érable à sucre accumule moins d’amidon, la richesse du milieu n’incitant pas l’arbre à accumuler de façon indue des réserves ni à investir dans la production, l’entretien et le renouvellement de radicelles très fines, mais plutôt à assurer leur croissance en diamètre et à mieux les répartir dans tout le profil de sol.
6.6 Conclusion
Les études menées démontrent que, parmi les différentes tailles des racines de l’érable à sucre, les radicelles (racines de diamètre < 2,0mm) jouent un rôle prépondérant dans la nutrition minérale de l'érable à sucre. Toutefois selon les conditions du milieu pédologique, l'arbre va produire et utiliser de façon différentielle les diverses classes de diamètre de radicelles. De plus, les radicelles jouent, selon leur taille, un rôle précis dans l'absorption des éléments minéraux, dans la production de certains métabolites et dans l'accumulation des réserves.
Bibliographie
Abrahamson, W. G. et H. Caswell, 1982. On the comparative allocation of biomass, energy, and nutrients in plants. Amer. J. Bot. 66 (1): 71-79.
Abrahamson, W. G., 1979. Patterns of resource allocation in wildflower population of fields and woods. Amer. J. Bot. 66 (1): 982-991.
Atkinson, D., 1985. Spatial and temporal aspects of root distribution as indicated by the use of root observation laboratory. Dans: A.H. Fitter, D. Atkinson, D.J. Read et M. Usher (éd.). Ecological interactions in soil. Plants, microbes and animals. Brit. Ecol. Soc. Spec. Publ. 4. Blackwell Scientific Pub., Oxford, 43-65.
Axelsson, E. et B. Axelsson, 1986. Changes in carbon allocation patterns in spruce and pines trees following irrigation and fertilization. Tree Physiology 2: 189-204.
Badibanga, B., 1994. Étude du système radiculaire de l’érable à sucre (Acer saccharum Marsh.) en relation avec le milieu pédologique. Caractérisations morphologiques, micromorphologiques et biochimiques. Thèse Ph. D., Univ. Sherbrooke, Sherbrooke, Québec, Canada, 225 p.
Badibanga, B., F. Pagé, A. Sauvesty et C. Ansseau, 1992a. Le système radiculaire dans les érablières du Québec. IL Le développement radiculaire en relation avec le microrelief et la roche-mère. Can.J. For. Res. 22: 1568-1574.
Badibanga, B., A. Sauvesty, F. Pagé et C, Ansseau, 1992b. Influence du milieu pédologique sur le statut nutritif et les teneurs en composés phénoliques et en amidon des radicelles d’érable à sucre. Agrosol 5 (1): 10-14.
Bauce, E. et D. C. Allen, 1992. Condition of the fine roots of sugar maple in différent stages of decline. Can. J. For. Res. 22: 264-266.
Bauce, E. S., 1989. Sugar maple, Acer saccharum Marsh., decline associated with past disturbance, Ph.D. Thesis, State Univ. New York, Col. Env. Sci. For., Syracuse, N.Y., 141 p.
Bazzaz, F. A., N. R. Chiariello, P. D. Coley et L F. Pitelka, 1987. Allocation resources to reproduction and defense. BioScience 37: 58-67.
Bernier, B. et M. Brazeau, 1988. Nutrient deficiency symptoms associated with sugar maple dieback and decline in the Quebec Appalachians. Can. J. For. Res. 18: 76.
Bloom, A.J., F. S., Chapin M et H. A. Mooney, 1985. Resource limitation in plant. An economic analogy. Ann. Rev. Ecol. Syst. 16: 63-392.
Callot, G., H. Chamayoy, C. Maertens et 1. Solsoc, 1982. Mieux comprendre les interactions sol-racine. Incidences sur la nutrition minérale. INRA, Paris, 325 p.
Carroll, J. E., T. A. Tattar et P. M. Allard, 1982. Automn root starch content and its relationship with severity of decline symptoms in urban sugar maple. Phytopathology, 72: 258.
Chapin M, F. S., A. J. Bloom, C. B. Field et R. H. Waring, 1987. Plant responses to multiple environmental factors. BioScience 37: 49-57.
Chung, H. H. et P.J. Kramer, 1975. Absorption of water and 32P through suberized and unsuberized roots of Loblolly pine. In: Drew, M. C., 1979. Properties of roots which influence rates of absorption. Dans: Harley, J. L. and R. Scott Russel, 1979, (éd.). The soil-root interface. Academic Press, London, 21-38.
Clarkson, D. T. etA. W. Robards, 1975. The endodermis, its structural development and physiological role. Dans: Torrey, J. G. and D.T. Clarkson (éd.). The development and function of roots. Academic Press, London, 415-436.
Dessureault, M., 1985. Le dépérissement des arbres: nature, causes et mécanismes. Phytoprotection 66: 71-81.
Drew, M. C., 1979. Properties of roots which influence rates of absorption. Dans: J.L. Harley and R. Scott Russel (éd.). The soil-root interface. Academic Press, London, 21-38.
Garrec, J. P., 1989. Étude des perturbations des surfaces foliaires dans les arbres dépérissants. Colloque: Ateliers sur le dépérissement des érablières. SaintHyacinthe, Québec.
Gleeson, S. K. et D. Tilman, 1990. Allocation and the transient dynamics of succession on poor soils. Ecology 71 (3): 1144-1155.
Harris, W. F., D. Santantonio et D. McGinty, 1980. The dynamic belowground ecosystem. Dans: R.H. Waring (éd.). Forests: fresh perspectives from ecosystem analysis. Oregon State Univ. Press, Corvallis, Oregon, 119-129.
Hendershot, W., 1988. Le rôle de l’acidification du sol et du lessivage relié au dépérissement des érablières. Colloque sur le dépérissement des érablières, Granby, Québec.
Kramer, P. J. et T. T. Kozlowski, 1979. Physiology of woody plants. Academic Press, New York, 881 p.
Lambers, H., R. K. Szaniawski, et R. De Visser, 1983. Respiration for growth, maintenance and ion uptake. An evaluation of concepts methods, values and their significance. Physiol. Plant. 58: 556-563.
Lortie, M., 1966. Observations sur l’enracinement du bouleau à papier à la suite d’études sur le dépérissement. Naturaliste Can. 93: 199-206.
Mc Donald, A. J. S., T. Lohammar et A. Ericsson, 1986. Uptake of carbon and nitrogen at decreased nutrient availability in small birch (Betula pendula Roth) plants. Trees Physiol. 2: 61-71.
McLaughlin, S. B., R. K. McConathy, IL L. Barnes et N. T. Edwards, 1980. Seasonal changes in energy allocation by white oak (Quercus alba L.). Can. J. For. Res. 10: 379-388.
Mooney, H. A, 1972. The carbon balance of plants. Ann. Rev. Ecol. Syst. 3: 315-346.
Nguyen, P. V., D. 1. Dickmann, K. S. Pregitzer et R. Hendrick, 1990. Late season changes in allocation of starch and sugar to shoots, course mots, and fine roots in two hybrid poplar cones. Tree Physiol. 7: 95-105.
Orians, G. H. et 0. T. Solbrig, 1977. A cost-income model of leaves and roots with special reference to arid and semi- arid areas. The American Naturalist, 111 (980): 677-690.
Paré, D. et B. Bernier, 1989. Origin of the phosphorus deficiency observed in declining sugar maple stands in the Quebec Appalachians. Can. J. For. Res. 19: 24-34.
Persson, H., 1980. Spatial distribution of fine-root growth, mortality and decomposition in a young Scots pine stand in Central Sweden. Oikos 34: 77-87.
Persson, H., 1978. Root dynamics in young Scots pine stand in Central Sweden. Oikos 30: 508-519.
Philipson, J. J., 1988. Root growth in Sitka spruce and Douglas-fir transplants: dependence on the shoot and stored carbohydrates. Tree Physiol. 4: 101-108.
Pomerleau, R. et M. Lortie, 1962. Relationship of dieback to the rooting depth of white birch. For. Sci. 8: 219-224.
Pregitzer, K. S., D. L. Dickmann, & Hendrick et P. V. Nguyen, 1990. Whole-tree carbon and nitrogen partitioning in young hybrid poplars. Tree Physiol. 7: 79-93.
Sauvesty, A., F. Pagé, B. Badibanga et M. Giroux, 1993. Perturbations physiologiques de l’érable à sucre et dégradation des milieux pédologiques: conséquences du changement climatique global. Eurêka 34: 7-9.
Sauvesty, A., F. Pagé, M. Giroux et G. Laferrière, 1991. Les composés phénoliques, un indicateur physiologique de stress pour l’érable à sucre. Agrosol 4 (1): 54-58.
Sauvesty, A., F. Pagé et M. Giroux, 1989. Le dépérissement des érables: interprétation physiologique du dépérissement. Agrosol, 2 (1): 34-46.
Schulze, E. D. 1989. Air pollution and forest decline in a spruce (Picea abies) forest. Science 244: 776-783.
Van Praag, H.J., S. Sougnes-Remy, F. Weissen et G. Carletti, 1988. Root turnover in a beech and a spruce stand of the Belgian Ardennes. Plant and Soil 105: 87-103.
Wargo, P. M,, 1983. Effects and consequences of stress on root physiology. J. Arboric. 9 (7): 173-176.
Wargo, P. M., 1979. Starch storage and radial growth in woody roots of sugar maple. Can. J. For. Res. 9: 49-46.
Yin, X., J. A. Perry et R. K. Dixon, 1989. Fine-root dynamics and biomass distribution in a Quercus ecosystem following harvesting. For. Ecol. Manage. 27: 159-177.
7 Le cycle des éléments nutritifs dans l’érablière
David Paré
7.1 Introduction
En milieu forestier, la grande majorité des éléments qui sont prélevés annuellement par les plantes provient des cycles internes à l’écosystème. En d’autres termes, ces éléments ont, en bonne partie, déjà été utilisés par le peuplement et sont recyclés par différents mécanismes. Les transferts d’éléments dans l’écosystème forestier s’effectuent dans un système à l’intérieur duquel il existe de nombreuses rétroactions. Ceci implique qu’un changement à l’un des flux d’éléments (par exemple une plus grande disponibilité des éléments nutritifs dans le sol après fertilisation) peut avoir des répercussions sur l’ensemble de la circulation des éléments dans l’écosystème (c.- à-d. sur le prélèvement, sur les retours par chute de litière, sur la minéralisation, etc.). Conséquemment, la compréhension des causes et des solutions aux problèmes nutritifs observés dans les érablières dépérissantes du Québec (Bernier et Brazeau, 1988a, b, et c; Bernier et al., 1989; Ouimet et Camiré, 1995) doit s’appuyer sur une connaissance du cycle des éléments dans l’érablière. Dans ce chapitre, un modèle de base du cycle des éléments nutritifs dans l’érablière sera présenté. Ensuite, il sera question de la variabilité des flux d’éléments dans les érablières. Finalement, une description plus détaillée du cycle des principaux éléments nutritifs sera présentée.
7.2 Modèle de base de la circulation des éléments nutritifs dans l’erablière
Dans les écosystèmes terrestres, on distingue essentiellement trois cycles: le cycle biochimique, le cycle biogéochimique et le cycle géochimique.
7.2.1 Le cycle biochimique
Il s’agit du cycle des éléments à l’intérieur des organismes. Chez les arbres, des quantités importantes d’éléments nutritifs peuvent être recyclées par retranslocation de zones peu actives (feuilles sénescentes, bois de coeur) vers des zones plus actives (nouveau feuillage, aubier) (van Den Driessche, 1984). Ces transferts d’éléments peuvent contribuer à une partie substantielle des besoins nutritifs des arbres, plus particulièrement des besoins en azote (N) et en phosphore (P) (van Den Driessche, 1984). Ryan et Bormann (1982) ont évalué que la retranslocation d’éléments avant la chute des feuilles contribue à 34 et 30% des besoins en N et P respectivement chez l’érable à sucre (Acer saccharum Marsh.). Il est aussi possible que le potassium (K), élément peu retransloqué des feuilles avant la chute de litière (Ryan et Bormann, 1982), soit retransloqué lors de la formation de bois de coeur. Ce mécanisme a été observé chez plusieurs espèces forestières (Attiwill, 1980; Bamber et Fukazawa, 1985), mais n’a pas été étudié chez l’érable à sucre. Il convient de signaler que de façon générale, la contribution de ce cycle aux besoins nutritifs augmente avec l’âge des arbres (Miller, 1984).
Paré et al., (1993) ont observé qu’une seule fertilisation de P et K avait des effets sur les concentrations foliaires qui duraient au moins trois ans alors que les effets sur le sol s’estompaient rapidement. Ces observations suggèrent que la retranslocation contribue à prolonger l’effet de la fertilisation.
Les végétaux possèdent aussi une certaine plasticité au cyclage interne des éléments et la plupart des plantes peuvent réagir à une baisse des quantités d’éléments nutritifs dans le sol en augmentant la récupération d’éléments des tissus senescents. On assiste alors à une baisse des quantités d’éléments dans la litière lorsque les arbres sont en proie à un stress nutritif (Boerner, 1984; van den Driessche, 1984). Ceci aura des incidences sur le cycle biogéochimique.
7.2.2 Le cycle biogéochimique
Ce cycle est constitué des flux d’éléments à l’intérieur de l’écosystème. Les principaux flux sont la restitution, la minéralisation et le prélèvement.
7.2.2.1 La restitution
Elle constitue l’ensemble des transferts d’éléments des végétaux au sol. Ceci comprend les sentiers suivants: 1- la chute de litière (feuilles, fruits, branches, etc.) mais aussi l’apport des composantes hypogées, c’est-à-dire la litière de racines et de radicelles; 2- le pluviolessivage ou entraînement des éléments des feuilles et de l’écorce des arbres au sol par le lessivage de la pluie. On peut distinguer deux composantes du pluviolessivage: l’écoulement le long du tronc et l’égouttement du houppier. Le pluviolessivage est influencé par la qualité des précipitations et généralement le lessivage des éléments augmente avec une augmentation de l’acidité des précipitations (Parker, 1983). La présence de dommages aux feuilles causés par des organismes pathogènes est aussi susceptible d’augmenter les quantités d’éléments retournées au sol par le pluviolessivage (Parker, 1983); 3- les exsudats racinaires. Les retours d’éléments au sol par ce sentier ont été estimés dans une forêt de feuillus nordiques par Smith (1976) et semblent faibles. Cependant, les difficultés techniques de mesure de ce flux rendent peu fiables les estimations que l’on possède à ce jour.
7.2.2.2 La minéralisation
Afin d’être disponibles pour l’absorption racinaire, les éléments contenus dans la litière doivent être sous forme minérale. La minéralisation est effectuée par la microflore (bactéries et champignons) et par la faune du sol. Elle est influencée par des facteurs extrinsèques à la litière, soit la température, le taux d’humidité du sol, les organismes, le pH du sol, etc. ainsi que par des facteurs intrinsèques à la litière, à savoir les propriétés physiques (épaisseur de la cuticule, dureté, taille), les propriétés nutritives (contenu en éléments nutritifs, qualité énergétique) et, finalement, la présence de composés non nutritifs qui influencent l’attaque par les organismes du sol (tannins, résines, composés allélopatiques) (Swift et al., 1979). Plusieurs indices tels le rapport lignine/N (Melillo et al., 1982), le rapport C/N (Taylor et al., 1989) ou encore les rapports cutine/N et cutine/P (Gallardo et Merino, 1993) reflètent la qualité de la litière en regard de sa vitesse de décomposition.
7.2.2.3 Le prélèvement
Dans les écosystèmes forestiers, les végétaux puisent leurs nutriments principalement dans les horizons de surface du sol (la couverture morte). Dans une érablière du New Hampshire, Wood (1980) estime que plus de 80 % des surfaces de radicelles se situent dans les dix premiers centimètres du sol. Cette proportion pourrait être plus forte sur sol acide que sur sol calcaire où l’on retrouve un enracinement plus profond (Badibanga et al., 1990). Les radicelles de l’érable à sucre sont normalement endomycorhizées. Cette association entre l’arbre et un champignon contribue à un meilleur prélèvement de l’eau et des éléments qui diffusent lentement dans le sol, en particulier le P, le zinc (Zn) et le cuivre (Cu) (Clarkson, 1985).
7.2.3 Le cycle géochimique
Ce cycle est constitué des transferts d’éléments entre écosystèmes. Il concerne donc les intrants et les extrants.
7.2.3.1 Les intrants
Les principaux intrants d’éléments nutritifs aux écosystèmes sont l’altération des roches et minéraux, les apports atmosphériques et la fixation biologique de l’azote. L’altération est un mécanisme important pour l’apport des éléments calcium (Ca), magnésium (Mg), K et P dans l’écosystème. La nature du matériel originel influence grandement l’apport de ces éléments. Les apports atmosphériques sont constitués des dépôts secs et des dépôts humides (pluie, neige, brouillard). La pollution atmosphérique peut contribuer à des apports substantiels d’azote et de soufre (S) aux écosystèmes (Abrahamsen, 1983). Finalement, la fixation de l’azote dans l’érablière n’a reçu que peu d’attention. On ne retrouve que rarement des plantes ayant la capacité de fixer l’azote atmosphérique (N2) dans l’érablière mais il est possible que la fixation asymbiotique de N2 ait une certaine importance. Dans une érablière du New Hampshire, Bormann et Likens (1979) évaluent à 14 kg N ha-1 an-1 les apports d’azote par ce mécanisme.
Les principaux extrants sont le lessivage, la fixation chimique, la dénitrification, les pertes par érosion et les pertes par exportation de biomasse lors de l’exploitation forestière. Le lessivage de cations est lié au transport d’anions dans le sol. Les principaux anions dans la solution du sol sont les sulfates, les nitrates, les chlorures, les carbonates (selon le pH) et les anions organiques. Courchesne et Hendershot (1988) estiment que le lessivage de Ca, Mg, et K de la litière est principalement contrôlé par les sulfates et les anions organiques. Cependant, les véritables pertes pour l’écosystème, c’est-à-dire les pertes dans la nappe phréatique, sont aussi fonction de la richesse du matériel originel et de la capacité abiotique et biotique de l’écosystème à retenir les anions. Les dépôts acides contribueraient à augmenter les pertes par lessivage (altération accélérée des minéraux), pour autant que NO3 ne soit pas prélevé ou que SO4 ne soit pas fixé.
La fixation chimique d’éléments nutritifs peut être considérée comme une perte pour l’écosystème puisque les éléments fixés ne sont plus disponibles à court terme pour les végétaux. Le potassium et l’ammonium peuvent être fixés entre les feuillets d’argile. Les argiles de type 2:1 (vermiculite > illite > montmorillonite) ont des capacités de fixation élevées de K+ et NH4+ (Stevenson, 1986). Le NH3 peut aussi être fixé par la matière organique du sol et former des composés stables (Stevenson, 1986). Le P est fixé, en sol acide, par le fer (Fe), l’aluminium (AI) et le manganèse (Mn) en solution, ainsi que par les oxydes hydreux de Fe et de AI et l’argile. En sol calcaire, le P forme des complexes avec le Ca (Brady, 1984). La dénitrification se produit en milieu mal aéré ou lors de périodes de sécheresse suivie de périodes de pluies abondantes, et ne devrait donc être importante que dans les érablières mal drainées. Ce phénomène n’a cependant pas reçu beaucoup d’attention. Finalement, les pertes par érosion sont faibles dans les érablières à moins que le sol en pente n’ait subi une perturbation physique sévère.
7.3 Importance relative des cycles à la nutrition des peuplements
Après avoir décrit les principaux flux d’éléments dans l’écosystème de l’érablière, il est pertinent d’évaluer la contribution relative de ces flux à la nutrition du peuplement. Il existe peu d’érablières où la caractérisation des flux d’éléments a été réalisée d’une manière intégrée. La forêt expérimentale de Hubbard Brooks au New Hampshire fait exception et est l’une des forêts les plus étudiées au monde. Le modèle de circulation des éléments dans cet écosystème (Likens et al., 1977; Whittaker et al., 1979) est donc présenté ici et servira de modèle de base pour l’évaluation de la contribution des différents flux d’éléments à la nutrition du peuplement. On doit toutefois souligner que des variations substantielles par rapport à ce modèle peuvent être observées dans d’autres écosystèmes d’érablières où l’on retrouve des sols, des climats ou des régimes de perturbations différents. Nous ne possédons que peu de connaissances sur la variabilité de ces flux entre érablières.
Le tableau 7.1A présente les estimations des flux annuels d’éléments dans la forêt de Hubbard Brooks. Le tableau 7.1B présente ces mêmes données mais cette fois exprimées en proportion de la quantité totale d’éléments qui devient disponible annuellement. On constate que la plus grande contribution annuelle d’éléments au pool d’éléments disponibles provient des apports biogéochimiques. En effet, les apports internes à l’écosystème contribuent à des valeurs allant de 79 à 88 % des quantités d’éléments devenant disponibles pour N, P, et K et de 59 à 69 % pour Ca, Mg et S. La minéralisation de la litière est le plus important sentier pour tous les éléments sauf pour K où le pluviolessivage domine. Les apports provenant de l’atmosphère ou de l’altération de la roche sont faibles par rapport aux apports internes à l’écosystème. Par ailleurs, les pertes hors du système sont faibles en rapport avec les quantités d’éléments qui circulent dans l’écosystème.
Tableau 7.1 A Flux des éléments nutritifs dans une érablière (d’après Likens et al., 1979).
Tableau7.lB Flux des éléments nutritifs dans une érablière (d’après Likens at al., 1979)
intrants géochimiques + intrants biogéochimiques = 100 %
*valeurs exprimées en % de la quantité d’éléments devenant disponsibles annuellement
7.4 Variabilité des flux d’éléments
Le flux d’éléments nutritifs le plus fréquemment mesuré dans les écosystèmes forestiers est la chute de litière. Pour cette raison, la mesure de ce flux est utilisée ici pour illustrer la variabilité des flux d’éléments que l’on peut retrouver entre érablières. Le tableau 7.2 regroupe les flux d’éléments par chute de litière dans plusieurs érablières. On constate une forte amplitude de la variabilité de ces transferts d’éléments par rapport au modèle présenté précédemment. Le peu de données disponibles sur les flux d’éléments dans les érablières limite l’interprétation de cette variabilité. Il est en effet difficile de savoir quelle est l’amplitude de la variation dans les flux d’éléments qui peut être considérée comme normale lorsqu’on tient compte de la variabilité des caractéristiques édaphiques et de la composition des peuplements que l’on retrouve dans les écosystèmes des érablières. Un monitoring du flux des éléments dans les différents types d’érablières du Québec permettrait de mieux caractériser l’amplitude du flux des éléments que l’on retrouve dans les érablières québécoises.
Les valeurs de flux d’éléments par chute de litière observées dans plusieurs érablières dépérissantes du Québec sont inférieures aux valeurs observées dans d’autres érablières nord-américaines (tableau 7.2). Des études soutenues du cycle des éléments nutritifs permettraient de savoir si cette situation est temporaire ou si elle représente une tendance vers un appauvrissement des stations. La résilience des érablières, c’est-à-dire leur capacité à retourner à leur état d’origine après une perturbation, n’est pas bien connue.
Tableau 7.2 Flux d’éléments par chute de litière dans plusieurs érablières
7.5 Description du cycle de plusieurs éléments dans l’érablière
7.5.1 Cycle du potassium
Le potassium est l’élément nutritif qui a été le plus fortement associé au dépérissement des érablières dans les Appalaches (Bernier et Brazeau, 1988a, Bernier et al., 1989). Les quantités de cet élément qui circulent dans les écosystèmes forestiers proviennent principalement des minéraux primaires suivants: les micas et les feldspaths potassiques (orthose et microcline). Elles peuvent aussi provenir de minéraux secondaires comme le K fixé entre des feuillets d’argile. Les sols issus de roches ultra-mafiques sont pauvres en K et les apports atmosphériques de cet élément sont généralement faibles sauf aux abords des océans (Binkley, 1986; Parker, 1983). Ces sources ne fournissent qu’une fraction du K prélevé annuellement par les plantes. Par contre, le pluviolessivage et la minéralisation de la litière contribuent à renflouer la majeure partie des réserves de K disponible du sol et à supporter le prélèvement par les plantes (voir tableau 7.1A). Néanmoins, la minéralogie de la roche-mère apparaît comme un facteur important permettant d’expliquer la variabilité du statut nutritif en K rencontré dans les érablières du Québec. Ainsi les déficiences les plus marquées ont été retrouvées dans les Appalaches sur des sols issus de roches pauvres en K (Bernier et Brazeau, 1988a). Par ailleurs, les sols issus de roches granitiques semblent présenter une nutrition en K adéquate (Bernier et Brazeau, 1988b). En milieu forestier, on retrouve surtout des carences en K sur des sols à texture grossière (Binkley, 1986), sur des sols organiques drainés (Binkley, 1986) ou sur des sols épuisés par l’agriculture (Shepard et Mitchell, 1990). Le cas des érablières des Appalaches déficientes en K est donc particulier.
De nombreux facteurs peuvent accentuer les problèmes de nutrition en K dans les érablières croissant sur des sols pauvres en cet élément. Le K est un élément qui est peu lié aux structures organiques et qui a une prépondérance pour le lessivage foliaire (Parker, 1983). Une augmentation du lessivage foliaire peut être causée par une augmentation de la quantité de K disponible dans le sol, par une augmentation de l’intensité ou de l’acidité des précipitations et finalement, par les dommages au feuillage dû aux insectes, aux pathogènes ou aux polluants (Parker, 1983; Schulze, 1989). Un accroissement du lessivage foliaire qui ne serait pas compensé par un plus grand prélèvement conduirait à une déficience en K. Gosz et al., (1975) observent que le K est l’élément qui est lessivé en plus grande quantité du feuillage de l’érable à sucre et que cette espèce montre des taux de lessivage foliaire plus élevés que le bouleau jaune et le hêtre. Le K peut aussi être lessivé du sol. L’importance de ce phénomène est liée à l’acidité et à la quantité des précipitations, à la fixation des anions dans le sol et à l’importance du prélèvement par les plantes. Sur sols forestiers acides, la rétention des sulfates par les oxydes de fer et d’aluminium limite le lessivage (Binkley, 1986).
Dans les écosystèmes forestiers, le cycle du K est largement contrôlé par la végétation. En effet, au cours de la succession dans plusieurs écosystèmes forestiers tempérés, le K, contrairement aux autres éléments majeurs, est accumulé plus rapidement dans la végétation que dans la couverture morte (Pearson et al., 1987; Rodin et Basilevich, 1967). De plus, Likens et al., (1970) observent que lorsque le prélèvement d’éléments par les arbres dans une forêt feuillue du nord-est américain est stoppé par la coupe et l’application massive d’herbicides, les pertes de K par lessivage augmentent plus que les pertes de tout autre élément. L’augmentation des pertes était de 1558 % pour K et de 417 %, 408 % et 177 % pour Ca, Mg et le sodium (Na) respectivement. On comprend donc que le prélèvement du K par la végétation est un mécanisme important pour la rétention de cet élément dans l’écosystème. Ainsi, une baisse dans la vigueur du peuplement, causée par un stress climatique, biotique ou anthropogénique pourrait conduire à un ralentissement du cycle du K.
Des études menées à Hubbard Brooks sur une période de dix ans ont permis de constater que le lessivage du K par les eaux de drainage suit un patron annuel particulier: le lessivage est plus élevé que les intrants de K dans l’écosystème pour la période allant de décembre à juin, avec une pointe au mois d’avril alors que le lessivage du K est de six fois supérieur à ce qu’il est durant l’été (Likens et al., 1977).
La fertilisation d’érablières déficientes en K montre des résultats prometteurs. Ce traitement a permis, dans plusieurs érablières, une rapide restauration des concentrations foliaires (Bernier et al., 1989; Hendershot, 1991; Paré et al., 1993) qui peut se maintenir pour une période d’au moins trois ans après fertilisation (Paré et al., 1993). On constate aussi que la fertilisation a un impact sur plusieurs composantes du cycle, entre autres sur la quantité de K parvenant au sol par chute de litière (Bernier et al., 1989) et sur le pluviolessivage (Boutin et al., 1990).
7.5.2 Cycle du phosphore
Le cycle du P dans l’érablière est très étanche aux pertes. De faibles quantités parviennent à l’écosystème par dépositions atmosphériques ainsi que par altération de la roche (principalement l’apatite) et de faibles quantités en sortent par les eaux de ruissellement (Likens et al., 1979). Cependant, des quantités importantes de P circulent entre le sol et les plantes. La circulation de P dans l’érablière est contrôlée par des mécanismes biologiques (prélèvement par les plantes et par les micro-organismes du sol) ainsi que par des mécanismes physico-chimiques. En sol acide, le mécanisme dominant est la fixation du P sur les oxydes libres de fer et d’aluminium qui sont présents en grandes quantités dans les horizons B, particulièrement chez les podzols. En sol neutre à basique, le P est fixé par le Ca. La matière organique et les argiles peuvent aussi jouer un rôle dans la rétention du P. Dans les érablières sur sols à humus mor, les mécanismes biologiques de contrôle du P et les mécanismes physico-chimiques ne sont pas concentrés au même endroit dans le profil de sol. Les mécanismes biologiques sont situés à la surface du sol, dans la couverture morte, et sont quasi absents des horizons minéraux, tandis que les mécanismes physico-chimiques de rétention du P sont situés dans les horizons B minéraux (Wood, 1980).
Dans les érablières des Appalaches au Québec, la nutrition phosphatée des peuplements n’est pas rattachée, comme c’était le cas pour le K, à la nature de la roche-mère. La nutrition en P semble plutôt rattachée à la forme d’humus (Paré et Bernier, 1989a). Les forêts sur des sols ayant un humus de type mor présentent une nutrition en P adéquate alors que les forêts sur des sois ayant des humus de type mull acide présentent des carences en P. L’hypothèse émise par Paré et Bernier (1989a) pour expliquer ces observations est que la présence d’une macro- faune dans les humus de type mull acide entraine la remontée d’oxydes de fer et d’aluminium à la surface du sol et que ces composés entrent en compétition directe avec les racines des arbres pour le P.
Par ailleurs, les humus de type mor, malgré une acidité élevée, n’ont qu’une faible capacité à immobiliser chimiquement le P parce qu’ils ne contiennent que peu de composés susceptibles d’immobiliser cet anion. Les sols à humus de type mor contiennent de grandes quantités d’oxydes de fer et d’aluminium libres dans l’horizon B, mais l’absence d’une faune fouisseuse fait en sorte que ces composés ne se retrouvent jamais à la surface. Ainsi, les quelque dix premiers centimètres du sol sont libres d’immobilisation chimique de phosphore. Paré et Bernier (1989b) ont de plus démontré en laboratoire que l’acidification des humus de type mull acide entraîne une baisse des quantités de P disponible alors que l’acidification n’a pas d’effet sur la disponibilité de P dans les humus de type mor. Il est difficile de savoir si les déficiences en P observées dans certaines érablières dépérissantes des Appalaches proviennent de l’introduction récente de vers de terre qui perturbent l’équilibre de la nutrition en P, d’une augmentation de l’acidité des sols à humus de type mull acide ou d’une combinaison de ces deux mécanismes. Il est à noter que les travaux de Reynolds (1973, 1977) suggèrent que les vers de terre ne sont pas indigènes au nord-est de l’Amérique du Nord et que leur présence serait attribuable à l’arrivée de colons européens.
Les quantités de P circulant dans certaines érablières des Appalaches sont extrêmement faibles (Paré et Bernier, 1989a). Seul un suivi de ces peuplements permettra de savoir si la restauration des flux de P peut s’effectuer sans interventions humaines. Les essais de fertilisation ont donné des résultats encourageants (Bernier et al., 1989; Paré et al., 1993).
D’autres phénomènes peuvent, par ailleurs, amplifier les problèmes de nutrition en P sans toutefois permettre d’expliquer la distribution des carences en fonction du type d’humus. On peut mentionner ici les dommages aux racines causés par les dégels d’hiver et les défoliations par les insectes.
Le cycle du P dans les érablières sur sols calcaires n’a reçu que peu d’attention.
7.5.3 Cycle du magnésium
Les sols bien pourvus en Mg dérivent de sédiments calcaires et de roches éruptives. Les principaux minéraux contenant du Mg sont les ferromagnésiens, la biotite, la dolomie, l’olivine, la serpentine et la chlorite. Les roches ultramafiques sont riches en cet élément. Les forêts situées en régions côtières peuvent aussi recevoir des quantités appréciables de Mg par dépositions atmosphériques (Parker, 1983). Cependant, sur une base annuelle, la minéralisation de la matière organique du sol est la principale source de Mg dans les peuplements forestiers (tableau 7.1A). Au Québec, la nature de la roche-mère semble avoir une influence déterminante sur la nutrition des érablières en Mg. Bernier et Brazeau (1988b) ont observé des carences en Mg dans les basses Laurentides sur des sols à texture grossière issus de roches granitiques pauvres en Mg tandis que Ouimet et Camiré (1995) ont observé des déséquilibres de nutrition causés par un excès de Mg dans les Appalaches. Sur les stations pauvres en Mg le lessivage foliaire et le lessivage dans le sol peuvent affecter le cycle du Mg. Ces mécanismes sont accentués par les précipitations acides (Johnson et al., 1985).
Il est à noter que de fortes concentrations de Mg peuvent avoir un effet antagoniste sur le prélèvement d’autres cations. Marschner (1986) souligne la faible sélectivité des membranes cellulaires des racines pour l’absorption de cations ayant des propriétés physico-chimiques apparentées. Il est possible que les fortes concentrations de Mg retrouvées dans certains sols des Appalaches aient contribué à un déséquilibre nutritionnel en diminuant l’absorption de Ca et de K.
7.5.4 Cycle de l’azote
Les études menées sur le statut nutritif des érablières du Québec depuis le début des années 80 n’ont pas montré de carences en N (Bernier et al., 1989; Ouimet et Camiré, 1995).
Les différents flux de N dans les érablières ont été peu étudiés. La contribution de mécanismes tels que la fixation de N, la dénitrification et la nitrification au cycle de l’azote demeure peu connue. Mellilo (in Likens et al., 1977) évalue que 10 à 20 % de l’ammonium est nitrifié dans une érablière du nord-est américain non perturbée. Cependant, on peut s’attendre à ce que ce taux varie considérablement d’une érablière à l’autre.
Likens et al, (1977) ont émis l’hypothèse que le gel du sol en profondeur pouvait provoquer une production soutenue de nitrates. La nitrification, en plus d’acidifier le sol, peut favoriser la perte d’azote nitrique et de cations par lessivage. Finalement, il faut mentionner que des quantités importantes de N parviennent aux écosystèmes par apports atmosphériques. Ces composés proviennent en grande partie de la combustion d’hydrocarbures d’origine fossile surtout par les véhicules moteurs. Cet apport d’azote a un effet fertilisant. Cependant, on croit qu’un apport élevé de cet élément peut aussi avoir des effets néfastes sur les forêts en favorisant les pertes par lessivage ainsi que l’acidification du sol (Johnson et al, 1985). Plus récemment, on a émis l’hypothèse que des apports de N en quantités importantes entraînent des modifications complexes à l’écosystème qui peuvent perturber le cycle de plusieurs éléments nutritifs (Aber et al, 1989; Nihlgard, 1985). On croit qu’un apport de N peut augmenter l’activité photosyntétique, diminuer la production de radicelles et ainsi provoquer des carences en éléments nutritifs autres que l’azote.
7.5.5 Cycle du soufre
Le soufre est rarement limitant pour les écosystèmes forestiers. On s’intéresse surtout au cycle du S pour les effets secondaires que les ions sulfates ont sur le cycle des cations. Les apports atmosphériques de S en milieu forestier peuvent être considérables. En régions industrialisées, il est commun d’observer des apports annuels de 20 à 50 kg S-SO4 ha-1 alors que les besoins des forêts se situent entre 5 et 10 kg ha-1 (Binkley, 1986). Dans les érablières du Québec, les apports annuels seraient de l’ordre de 10 kg S-SO4 ha-1 (Boulet et Jacques, 1993). Les anions de sulfates (SO4 ) qui ne peuvent être immobilisés par les végétaux sont adsorbés par le sol ou lessivés hors de l’écosystème. Le lessivage de sulfate entraîne des pertes de cations pour l’écosystème et peut causer l’acidification des cours d’eau adjacents. L’adsorption de sulfate par le sol limite les pertes de cations. Meyer (1991) observe une forte variabilité de la capacité des sols des érablières des Appalaches à absorber les ions de sulfate. Cette propriété est rattachée au contenu en oxydes d’aluminium et de fer qui sont présents en grande quantité dans les horizons B podzoliques.
7.6 Conclusion
Les carences nutritives observées en concomitance avec le dépérissement des érablières au Québec indiquent une perturbation du cycle des éléments nutritifs. Bien qu’un effort de recherche ait permis de mieux comprendre les causes et les solutions à ce problème, beaucoup de travail reste à faire pour comprendre la vulnérabilité des écosystèmes à présenter des déficiences minérales, la variabilité dans la circulation d’éléments nutritifs qui existe entre les différents types d’érablières et enfin, les mécanismes de résilience.
Bibliographie
Abrahamsen, A., 1983. Effects of long range transported air pollutants on forest. Summary document. Dans: Ecological effects of Acid deposition, National Swedish Environment protection board. Rep. PM 1636: 191-197.
Aber, J. D., K. J. Nadelhoffer, P. Steudler et J. M. Melillo, 1989. Nitrogen saturation in Northern forest ecosystems. BioScience 39(6): 378-386.
Attiwill, P. M., 1980. Nutrient cycling in a Eucalyptus obliqua (L’Hérit.) forest. IV. Nutrient uptake and nutrient return. Aust. J. Bot. 28: 199-222.
Badibanga, B., F. Pagé et C. Ansseau, 1990. Le développement radiculaire dans deux érablières à sucre en relation avec le microrelief et la roche-mère. Dans: Camiré, C., W. Hendershot et D. Lachance (éd.). Le dépérissement des érablières, causes et solutions possibles. C.R.B.F., Fac. for. géom., Univ. Laval, Québec: 139-148.
Bamber, R. K. et K. Fukazawa, 1985. Sapwood and heartwood: A review. For. Abstract 46 (9): 567-580.
Bernier, B. et M. Brazeau, 1988a. Foliar nutrient status in relation to sugar maple dieback and decline in the Quebec Appalachians. Can. J. For. Res. 18: 762-767.
Bernier, B. et M. Brazeau, 1988b. Magnesium deficiency symptoms associated with sugar maple dieback in a Lower Laurentians site in southeastern Quebec. Can.J.For.Res. 18: 1265-1269.
Bernier, B. et M. Brazeau, 1988c. Nutrient deficiency symptoms associated with sugar maple decline in the Quebec Appalachians. Can. J. For.Res. 18:762-767.
Bernier, B., M. Brazeau, A. Brousseau et C. Camiré, 1985. Recherche sur le dépérissement et le statut nutritif de l’érablière des Appalaches au Québec. Rap. sur les travaux réalisés en 1984-1985, 62 p.
Bernier, B., D. Paré, M. Brazeau, 1989. Natural stresses, nutrient imbalances and forest decline in southeastern Quebec. Water, Air, and Soil pollut. 48: 239-250.
Binkley, D., 1986. Forest nutrition management. John Wiley and sons, New York, 290 p.
Boerner, IL E. J., 1984. Nutrient fluxes in litterfall in decomposition in four forests along a gradient of soil fertility in southern Ohio. Can. J. For. Res. 14: 794-802.
Bormann F. H. et G. E. Likens, 1979. Pattern and process in a forested ecosystem: disturbance, development, and the steady state based on the hubbard brook ecosystem study. Springer-Verlag, Berlin, 253 p.
Boulet, G. et G. Jacques, 1993. Programme d’échantillonnage des précipitations du Québec: Sommaire des données de la qualité des eaux de précipitations 1991, Min. Environ. Qué., Québec, PA-50.
Boutin R., G. Robitaille et C. Camiré, 1990. Compositon chimique des eaux d’égouttement sous couvert d’érables fertilisés et non fertilisés. Dans: Camiré, C., W. Hendershot et D. Lachance (éd.). Le dépérissement des érablières, causes et solutions possibles. C.R.B.F., Fac. for. géom., Univ. Laval, Québec, 208-203.
Brady, N. C., 1984. The nature and properties of soils. Macmillan Publishing Co. New York, 750 p.
Clarkson , D.T., 1985. Factors affecting mineral nutrient acquisition by plants. Ann. Rev. Plant Physiol. 36:77-115.
Courchesne, F. et W. H. Hendershot, 1988. Cycle annuel des éléments nutritifs dans un bassin versant forestier: contribution de la litière fraîche. Can. J. For.Res. 18: 930-936.
Gallardo, A. et J. Merino, 1993. Leaf decomposition in two mediterranean ecosystems of southwest Spain: Influence of substrate quality. Ecology 74: 152-161.
Gosz, J. R., G. E. Likens, J. S. Eaton et F. H. Bormann, 1975. Leaching of nutrients; from leaves of selected tree species in New Hampshire. Dans: Howell, F. G., J. B. Centry et M. H. Smith (éd.). Mineral cycling in southeastern ecosystems, 630-641.
Hendershot, W. H., 1991. Fertilization of sugar maple showing dieback symptoms in the Quebec Appalachians, Canada. Fertilizer Res. 27: 63-70.
Johnson, D. W., D. D. Richter, G. M. Lovett et S. E. Lindberg, 1985. The effects of atmospheric deposition on potassium, calcium, and magnesium cycling in two deciduous forests. Can. J. For. Res. 15: 773-782.
Likens, G. E., F. H. Bormann, N. M. Johnson, D. W. Fisher et& S. Pierce, 1970. Effects of forest cutting and herbicide treatment on nutrient budget in the Hubbard Brook watershed-ecosystem. Ecol. Monog. 40 (1): 23-47.
Likens, G. E., F. H. Bormann, R. S. Pierce, J. S. Eaton et N. M. Johnson, 1977. Biogeochemistry of a forested ecosystem. Springer Verlag, New York, 146 p.
Marschner, H., 1986. Mineral nutrition of higher plants. Academic Press, New York, 543-648.
Melillo, J. M., J. D. Aber etj. F. Muratore, 1982. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics. Ecology 63:621-626.
Meyer, W. L., 1991. Sulfate sorption and ion movement in fertilized and unfertilized soil under sugar maple (Acer saccharum Marsh.) stand. Thèse de doctorat, Univ. Laval, Québec, Québec, 158 p.
Miller, H. G., 1984. Dynamics of nutrient cycling in plantation ecosystems. Dans: Bowen, G.D. et E. K. S. Nambiar (éd.). Nutrition of plantation forests. Academic Press, London, 53-78.
Morrison, I. K., 1991. Addition of organic matter and elements to, the forest floor of an oldgrowth Acer saccharum forest in the annual litter fall. Can. J. For. Res. 21: 462-468.
Nihlgard, B., 1985. The ammonium hypothesis, an additional explanation to the forest dieback in Europe. Ambio 14: 2-8.
Ouimet, R. et C. Camiré, 1995. Foliar deficiencies of sugar maple stands associated with soil cation imbalances in the Quebec Appalachians. Can. J. Soil Sci. 75: (sous presse).
Paré, D. et B. Bernier, 1989a. Origin of the phosphorus deficiency observed in declining sugar maple stands in the Quebec Appalachians. Can. J. For. Res. 19:24-34.
Paré, D. et B. Bernier, 1989b. Phosphorus fixing potential of Ah and H horizons subjected to acidification. Can. J. For. Res. 19: 132-134.
Paré, D., W. L. Meyer et C. Camiré, 1993. Nutrient availability and foliar nutrient status of sugar maple saplings following fertilization. Soil Sci. Soc. Am. J. 57: 1107-1114.
Parker, G. G., 1983. Throughfall and stemflow in the forest nutrient cycle. Adv. Ecol. Res.13:58-120.
Pearson, J. A., D. H. Knight et T. J. Fahey, 1987. Biomass and nutrient accumulation during stand development in Wyoming lodgepole pine forests. Ecology 68 (6):19661973.
Peterson, D. L. et G. L. Rolfe, 1982. Nutrient dynamics and decomposition of litterfall in floodplain and upland forests of central Illinois. For. Sci. 28(4): 667-681.
Reynolds J. W., 1973. Earthworm (Annelide: Oligochaeta) Ecology and Systematics. Dans: Dindal, D. (éd.). Proceedings of the first Soil Microcommunities conférence. U.S. Atomic Energy Comm. (Publ.) Syracuse, New York, 95-120.
Reynolds, J. W., 1977. The earthworms (Lumbricidae and Sparganophilidae) of Ontario. Life Sci. Misc. Pub., R. Ont. Mus., Toronto, 141 p.
Rodin, L E. et N. I. Bazilevich, 1967. Production and mineral cycling in terrestrial vegetation. Oliver and Boyd, Edinburgh and London, 288 p.
Rolle, G. L., 1975. Nutrient fluxes in litter fall in a central Illinois woodland. Univ. of Illinois, Dep. For., Urbana. For. Res. Rep. n’ 75-7.
Ryan, D. F. et F. H. Bormann, 1982. Nutrient resorption in northem hardwood forest. BioSci. 32(l): 29-32.
Shepard, A.N. et M. J. Mitchell, 1990. Nutrient cycling in a red pine plantation thirty-nine years after potassium fertilization. Soil Sci. Soc. Am. J. 54: 1433-1440.
Shulze, E.-D., 1989. Air pollution and forest decline in a spruce (Picea abies) forest. Science 244:776-783.
Smith, W.H., 1976. Character and significance of forest tree root exudates. Ecology. 57: 324-331.
Stevenson, F. J., 1986. Cycles of soil. John Wiley and Sons. New York, 380 p.
Swift, M.J., O. W. Heal et J. M. Andersen, 1979. Decomposition in terrestrial ecosystems. Univ. Calif. Press, Berkeley, California, 342-362.
Taylor, B.R., D. Parkinson et W. F. J. Parsons, 1989. Nitrogen and lignin content as predictors of litter decay rates: a microcosm test. Ecology 70: 97-104.
van den Driessche, R., 1984. Nutrient storage, retranslocation and relationship of stress to nutrition. Dans: Bowen, G.D. et E. K. S. Nambiar (éd.).Nutrition of plantation forests. Academic Press, London: 181-210.
Whittaker, R.H., G. E. Likens, F. H. Bormann, J. S. Eaton et T. G. Siccama 1979. The Hubbard Brook Ecosystem Study: forest nutrient cycling and element behaviour. Ecology, 60: 203-220.
Wood, T. E., 1980. Biological and chemical control of phosphorus cycling in a northern hardwood forest. Ph. D. thesis, Yale Univ., New Haven, Connecticut, 205 p.
8 Facteurs Perturbant Le Fonctionnement Des Écosystèmes Des Erablieres
8.1 Facteurs édaphiques
Robert Boutin
Fernand Pagé et Jean-Louis Brown
Bady Badibanga, Fernand Pagé, Annie Sauvesty et Colette Ansseau
6.3.2 Distribution verticale de la masse des radicelles en relation avec la roche-mère et le microrelief
David Paré
Robert Boutin
Measure That Vacuum
Extension
Maple Syrup Digest
H. Clay Smith and Arthur H. Rye, Northeastern Forest Experiment Station, Forest Service, U.S.D.A., Burlington, Vermont
Vol. 9, No. 2
July 1970
REF# 100
For vacuum pumping to increase sugar maple sap yields, there must be a vacuum at the taphole. The only way you can be sure that you have the necessary vacuum is to measure it.
One way to do this is to take the cap off the spout and attach a vacuum gage (fig. 1). But this is usually difficult and time consuming.

Figure 1. Measuring vacuum with a hand gage graduated in millimeters of mercury.
Now we have a better way. If shutoff valves are fitted to the tubing system at key points, vacuum gages can be attached quickly and simply for measuring the vacuum.
The key locations vary with each sugarbush. We put valves near the beginning and middle of the tubing lines. We also attach a few valves to the spouts farthest from the vacuum pump. In this way we can determine whether or not vacuum is present throughout the tubing installation.

The valves can be installed on the spout vents this way. Replace the spout cap with a piece of tubing containing a shutoff valve (fig. 2). Use plastic rubber cement to seal the tubing to the metal valve fitting. Keep the valve closed at all times except when vacuum readings are taken. If spouts without vent holes are used, insert a tee in the drop line beneath the spout and attach a valve to this tee. Valves can even be mounted on mainlines; however, in such cases larger valves should be used.
Figure 2. A valve is attached to the spout vent and kept closed until a reading is taken.
To measure the vacuum, attach a vacuum gage to the tubing above the valve while the valve is still closed (fig. 3). After the gage is attached, turn the valve on, wait for the needle on the gage to settle, read the vacuum, turn the valve off, and remove the gage.

Figure 3. When measuring vacuum, the gage is attached to the top of the valve and the valve is turned on.
If you have a good vacuum, you can open a valve slightly and hear a continuous hissing caused by the suction of air from the vacuum pump. When a vacuum is not present, check the entire installation to locate the problem areas. Things to check for include missing caps, separated lines, poor connections, leaking tapholes, broken fittings, and animal damage.
You can buy shutoff valves at most hardware or plumbing stores for approximately $0.50 each. Various types of shutoff valves with nipple thread combinations are available, but we found the ¼ inch valve fitting to be satisfactory.
Several types of vacuum gages are available. Vacuum gages measure vacuum in millimeters of mercury, inches of mercury, or pounds per square inch. They range in price from approximately $3.00 to several hundred dollars, and can be purchased at most hardware or mail order houses. An automobile fuel pump tester (vacuum gage), graduated in inches of mercury, works very well; one costs about $4.00.
Measuring vacuum on a tubing system can be slow and difficult. But the job can be done simply and quickly if shutoff valves are mounted on the spouts at key locations in the tubing lines. Remember, to increase sap yields, a vacuum must be present at the taphole.
The Use Of Vacuum Pumping In Michigan Sugarbushes
Extension
Maple Syrup Digest
Melvin R. Koelling, Department of Forestry, Michigan State University, East Lansing, Michigan
Vol. 9, No. 1
February 1970
REF# 102
The introduction of vacuum pumps to plastic tubing for the collection of maple sap is a relatively recent adaptation. Vacuum pumps themselves are not new, however, their use in maple sap collection systems has been rather limited until the past few years. Originally it was believed their advantages to the maple producer were primarily concerned with moving sap through or over areas where natural slope was insufficient to permit gravity flow.
The possibility that vacuum pumps might have additional benefits in sap collection has been the subject of several recent research studies. Results from these studies indicate that in addition to facilitating sap movement in tubing lines, additional increases in sap yields may be obtained from trees subjected to vacuum operated tubing lines. This latter increase is apparently due to the ability of the vacuum pump to pull more sap out of the taphole than would be obtained by gravity alone.
This report discusses the use of vacuum equipped tubing lines during the 1969 sugaring season in Michigan.
Field Installations
A source of vacuum for a tubing network may be obtained by any one of several types of pumping units. Two types are most commonly used, these being wet and dry pumps. Wet type units consist of a small centrifugal pump which forces sap through a well jet containing a Venturi tube. The centrifugal pump operates from a small recirculating reservoir of sap. Sap from the field line attached to an outlet on the Venturi tube continually replenishes sap in the reservoir.
Dry type units consist of a compressor type pump which evacuates a reservoir or chamber to which the field tubing line is attached. Provision must be made to periodically release the vacuum and empty the reservoir. Most commonly this results in an intermittent vacuum as opposed to a continuous vacuum on tubing lines equipped with a wet type pumping unit.
Vacuum pumps were introduced in Michigan sugarbushes in 1968. A small operation employing a wet type pump operating on approximately 750 tapholes was used in the northern portion of the state in that year.
In 1969 four producers used vacuum pumps on a portion of their tubing networks. Approximately 6000 tapholes were involved in the four operations. All pumps used were of the wet type, however, several different models of pumps with varying size Venturi tubes were employed. Two of the vacuum pumps were powered by electric motors and the remaining two were gasoline powered. Two of these installations used aerial tubing systems, one used a ground line, and the remaining installation had a combination of aerial and ground lines.
Results
The producers found that vacuum pumps were helpful in collecting sap. The greatest single advantage attributed to vacuum pumps was the increase in total seasonal sap yields which were obtained. All producers reported increases in yield with one producer noting a seasonal increase of approximately 80 percent.
This additional sap was obtained primarily during weeping or near weeping flows when temperatures and tree pressure conditions favorable for sap flow were marginal, however, increases in sap yield were also noted during good flow days. It was noted that on several marginal flow days, sap could be obtained from vacuum taps when comparable nonvacuum taps were not producing.
A second advantage cited for vacuum pumping systems is that unfavorable slope or lack of slope is not a major problem in using a tubing system for sap collection. Any slope present should be used if possible, but where a favorable slope is not present the use of vacuum will assist in sap movement over level or nearly level areas. With a tight vacuum system it is possible to move sap uphill through tubing lines for relatively short distances.
Other advantages related to slope include keeping the tubing lines relatively free of sap thereby reducing collection problems due to sap freezing in the tubing lines. This is particularly important in flat areas. The use of vacuum pumps can assist in incorporating into a tubing system areas where tubing previously could not be used due to a lack of adequate slope for gravity flow. By including these areas previous collection costs in emptying containers, opening up trails, and operating gathering equipment in such areas can be reduced or eliminated.
A third major advantage given is that vacuum pumps can help cover up some problems resulting from a poorly designed and installed tubing system. Such problems include leaky connections, overloaded lines (too many taps) and improperly graded lines. This problem should not exist but where it does vacuum pumping is advantageous.
Problems Of Operations
Although operators involved in vacuum pump usage believed the advantages outweighed the disadvantages, some problems were encountered. All of these can be overcome and none are believed to be a deterrent to use of pumps. Some major obstacles were:
1. Power is required to operate the pump. This may not be a serious problem particularly if electricity is present in or near the sugar bush. If electricity is not available a gasoline or other type of engine will be required. Servicing and maintenance will present minor problems in the use of such engines.
2. Leaks in the tubing lines, primarily at connections. This is a rather serious problem that must be overcome if pumping is to be successful. These leaks may occur at every connection in the system and occasionally may be difficult to detect. Care in drilling the tapholes and connecting all fittings and tubing together will help in minimizing leakage. A good ear and the use of a small vacuum gauge is of great value in locating leaks.
3. Freezing may be a problem in certain types of operations. In the use of wet type pumps, a reservoir of sap must be maintained to furnish the circulating liquid for the pump. This should be protected from freezing to enable continuous usage of the pump when desired. With dry type pumps, freezing may not be a serious problem. Where electricity is available the use of heat tapes or heating lamps that are thermostatically controlled has afforded good protection.
4. Periodic maintenance is required on the entire tubing system. This is also necessary on nonvacuum tubing systems, however, connection leaks, animal damage, or defective operation of the pumping unit are potentially more costly in vacuum installations.
Installation Suggestions
The use of vacuum pumps has given rise to some suggestions regarding their installation and maintenance which may be helpful to other would be users. Some of these are as follows:
1. Where possible use the minimum amount of tubing which will satisfactorily collect the sap from all trees to be tapped.
2. Keep the tubing system as simple and direct as possible to facilitate vacuum transmission and sap movement. When possible design the system so it would flow by gravity alone in event the vacuum pump were not operating.
3. Minimize the number of connections and fittings in the system. This, may be facilitated by placing tubing in the same location in successive years. A properly designed and coded tubing system will assist in this respect.
4. Do not use high heat sources to soften the tubing when installations are made. This will tend to enlarge the tubing and may be a source of leakage around connections.
5. A vacuum pump which supplies a constant vacuum as opposed to an intermittent type unit should yield greater increases in sap yield.
6. When using wet type pumps, impeller pumps will give longer maintenance free service than roller type pumps due to sugar accumulations.
Conclusions
The use of vacuum pumps is a relatively new approach to sap collection. The basic idea appears to be one that can greatly help the maple syrup producer reduce his sap collection costs and at the same time help stabilize annual production. Increases in sap yield of up to 100 percent can be expected, particularly during poor seasons.
The use of vacuum pumps appears to be an area where technology is ahead of completely reliable equipment. The development of complete, self contained units which the producer can simply connect a field line and use would be of considerable value. Information on the capacity of various size lines and pumps is also needed. In spite of these problems and some minor difficulties in installation and operation, the use of vacuum pumps offers considerable potential for increasing sap yields, assuring an annual crop and improving the overall economic position of maple producers.
Sugar Maple Sap Volume Increases As Vacuum Level Is Increased
Research
USDA Forest Service
Russell S. Walters and H. Clay Smith*, Research Foresters U.S. Department of Agriculture, Forest Service Northeastern Forest Experiment Station
Research Note NE-213
1975
REF# 291
Abstract. Maple sap yields collected by using plastic tubing with a vacuum pump increased as the vacuum level was increased. Sap volumes collected at the 10- and 15-inch mercury vacuum levels were statistically significantly higher than volumes collected at the 5-inch level. Although the 15-inch vacuum yielded more sap than the 10-inch vacuum, the difference was not statistically significant. An efficient vacuum system should have a vacuum level of at least 10 inches of mercury at the taphole.
Sugar maple sap yields are known to be greater when sap is collected on a hillside by gravity in a closed plastic pipeline than when a vented system is used (Blum 1967). This is because a natural vacuum is created by the weight of the sap flowing through the closed tubing line. A vacuum pump connected to an unvented tubing system can also increase sap yields. However, we did not know how much vacuum is needed to get the greatest sap yield.
Collecting sugar maple sap at three different levels of artificial vacuum – 5, 10, and 15 inches of mercury – we found greater yields from the higher vacuum levels.
Study Methods
In late February 1971, 15 trees located in a northwestern Vermont sugarbush were selected and tapped. Three tapholes were drilled in each tree. All the tapholes were drilled to the same dimension: 7/16 inch in diameter and 3 inches deep inside the bark. A gasoline-powered tapper was used to make the holes.
Each of the three tapholes per tree was assigned, at random, to one of three different vacuum levels – 5, 10, or 15 inches of mercury. Each taphole was connected by 5/16-inch plastic tubing to a separate 55-gallon steel drum, in which the sap from the taphole was collected (fig. 1).
Figure 1. (not available) Sap from each taphole was collected in individually sealed 55-gallon steel drums.
In each system, vacuum was developed in a central tank by a vacuum pump and transferred through plastic tubing to the individual collection drums located at each tree. The desired vacuum levels were maintained in each system by regulating pressurecontrol valves. Vacuum levels were monitored by gages located at the ends of the tubing systems farthest from the pumps.
Vacuum was applied to the systems for approximately 130 hours during, the sugaring season from March 19 to April 18. At the end of the sugaring season, the sap in each drum was measured to the nearest 1/2 liter.
Results
The results of this study indicated that the average sap-yield volumes per taphole varied positively with the vacuum levels. The greater the vacuum level, the greater the average sap yield. The average volumes were 37.8, 76.8, and 82.7 liters (40.0, 81.2, and 87.4 quarts) for the 5-, 10-, and 15-inch vacuum levels respectively. The sap volumes collected at the 10- and 15-inch vacuum levels were statistically significantly greater than the amount of sap collected at the 5-inch vacuum level. Sap volumes between the 10- and 15-inch vacuum levels were not statistically significantly different. Significant differences were determined at the 1-percent level.
These results are illustrated graphically in figure 2. The range of total per-taphole sap yields for each vacuum level is represented by the unshaded boxes. The average per taphole yield is indicated by a crossbar, and the shaded boxes represent ± 2 standard errors of the mean (Dice and Leraas 1936). A summary of the basic data is presented in table 1.

Figure 2. Average sap yield per tap for each vacuum level is indicated by the crossbar. The shaded areas indicate ± 2 standard errors of the means. The total length of the unshaded boxes represents the total range of individual taphole yields.
Table 1. Summary on analyses for comparing yields and vacuum levels

Discussion
It has long been known that maple sap will exude from a taphole or wound in dormant sugar maples when the internal pressure of the tree becomes greater than the external, or atmospheric, pressure (Jones and others 1903; Marvin 1958). This is a function of changes in temperature. Cold nights induce a negative pressure within a tree, resulting in moisture being absorbed through the roots. Warm days provide a positive internal pressure, forcing sap from the tree at tapholes or wounds. The volume of flow is not related to the temperature rise on the day of the flow, but rather to the length of the preceding cooling period.
A theory developed by Sauter** suggests that the mechanism of the sap-flow phenomenon is due to gas (mainly CO2) expanding and contracting in response to temperature changes. Under cooling conditions, CO2 contracts and dissolves in the sap, causing negative tree pressure. During warm daylight hours, CO2 is produced by living cells. Also, warming of tree drives the CO2 out of sap solution. The gas accumulates in spaces of the fibrous tissue and expands, creating positive tree pressure on the vessel, causing sap to flow out through the taphole.
Maple sap cannot be pulled or sucked from a taphole. Rather, it is forced out by a positive pressure differential when the pressure inside the tree is greater than the atmospheric pressure outside. Applying vacuum to a taphole has the effect of artificially reducing the external pressure, thus creating the pressure differential necessary to allow sap to flow from the tree.
In each sap season there are a number of days when conditions are almost right for a sap run. That is, the tree’s internal pressure is about equal to the atmospheric pressure. This situation also occurs for a period at the beginning and end of each sap run. It is during these times that a sap flow can be induced or prolonged by vacuum pumping to create a pressure differential. During periods of good sap-flow conditions, even heavier flows may be induced by vacuum.
The use of vacuum has raised questions about its effect on the composition of the sap collected. Maple sap is a very complex solution of sucrose, other sugars, minerals, and organic compounds. A large amount-about 98 percent of the dissolved solids-is sucrose. For the most part, these solutes diffuse from the living ray and parenchyma cells into the sap in the vessels. Because of the complexity of the constituents in maple sap and the mechanism whereby sap enters the vessels, concern developed that vacuum might possibly increase the amount of water in the sap, resulting in diluted sap.
Maybe various sap constituents respond selectively to the exertion of vacuum at the taphole, and maybe sap composition is altered by extracting more or less of the individual solutes. Vacuum may even cause the extraction of substances that do not normally appear in sap flowing from the taphole. Laing and others (1971) considered these possibilities and concluded that, under normal conditions of gravity flow, only a small volume of the available vessel sap reaches the taphole, and that vacuum pumping (as high as 25 inches of mercury) simply removes additional unaltered vessel sap.
Conclusions and Recommendations
We found that the higher the vacuum level generated within an unvented tubing system, the greater the sap yield will be. A vacuum level of at least 10 inches of mercury should be maintained at the taphole. The sap volume yielded by both the 10- and 15-inch vacuum levels was significantly greater than that yielded by the 5-inch level. However, the 15-inch volume was not significantly greater than that of the 10-inch level.
Further, results of this study and from other research strongly emphasized the importance of maintaining high vacuum at each taphole. To check the effectiveness of the vacuum system, age readings should be made at the ends of the pipeline system farthest from the pump. There is, of course, a loss of vacuum through friction in long tubing lines. This means that a vacuum level higher than 10 to 15 inches should be maintained at the pump, perhaps as high as 20 to 25 inches, in order to achieve the desired level at the taphole. Maintaining high vacuum requires constant inspection and maintenance of the tubing system.
*At the time this study was made, both authors were at the Northeastern Forest Experiment Statio’s laboratory at Burlington, Vermont. H. Clay Smith is now at the Experiment Station’s laboratory at Parsons, West Virginia.
**Sauter, Jorg. 1971. A new hypothesis for the mechanism of sap flow in sugar maple. Botany Seminar, University of Vermont, 10 May 1971.
Literature Cited
Blum, Barton M. 1967.
Plastic tubing for collecting maple sap: Comparison of suspended vented and unvented installations. USDA For. Serv. Res. Pap. NE-90. 13 p.
Dice, Lee R., and Harold J. Leraas.
1936. A Graphic Method For Comparing Several Sets Of Measurements. Univ. Mich. Lab. Vertebrate Genet. Contrib. 3. 3 p.
Jones, C. H., A. W. Edson, and W. J. Morse.
1903. The Maple Sap Flow. Vt. Agric. Exp. Stn. Bull. 103. 184 p.
Laing, F. M., J. W. Marvin, Mariafranca Morselli, David W. Racusen, E. L. Arnold, and Elizabeth G. Malcolm.
1971. Effect Of High-Vacuum Pumping On Volume Yields And Composition Of Maple Sap. Vt. Agric. Exp. Stn. Res. Rep. MP 65. 11 p.
Marvin, J. W.
1958. The Physiology Of Maple Sap Flow. In The Physiology Of Forest Trees: 95- 124. Ronald Press, New York.
Pipeline Pressure Testing To Detect Vacuum Leaks
Extension
Maple Syrup Digest
Dale E. Minick, President, Sugar Camp, Inc.
Vol. 25, No.3
October 1985
REF# 181
Anyone widely traveling about the maple producing regions and talking to producers using plastic tube networks and vacuum pumps for sap collection is soon struck by the wide variations in user satisfaction and success experienced with this technique. We’ve heard claims of sap yield increases ranging from 0 to 700 percent.
After awhile, the curious starts asking why this vast difference and the foolish starts seriously looking for answers. This article is a summarization of the “whys” we found over the past 8 or 10 years in hundreds of sugar bushes, doing private research, and from the review of published data. The findings and the solution will amaze you.
The Principle Problem
The major reason for poor pipeline performance is a lack of understanding on the part of the installer of the following previously unreported fact:
Air, Flows up to Ninety (90) Times More Freely
Through Pipes and Orifices Than Sap Does.
Please go back and read this statement at least one more time. This fact is extremely important to you as ignoring it prevents you from consistently increasing sap yield and causes you to waste a lot of your time, money and effort. Your pipeline is affected in two ways. For example:
1. Under a vacuum of 20″ hg, a hole as little as .050″ in diameter will leak a volume of air into your pipeline equal to the total volume of sap flow from 1,000 taps near peak flow times. A series of smaller holes has the same effect.
2. Once inside your pipeline that air will flow 90 times more freely than the sap and will therefore be pumped from your network first at the expense of improved sap flow. Those bubbles you see in your lines are passing through the sap, not pushing the sap ahead as much as they appear to be, because of the vast flow friction difference of air and sap.
In a worst case scenario, depending on the location of the leak or leaks, your pump could pump air almost exclusively all season long with sap flows being no more than they would have been under gravity flow, while still maintaining a vacuum gauge reading at the pump that really impresses your producer neighbors who are not as skillful as you are.
Considering this important new information and the current price of “Vacuum” in gallon cans, it should be obvious that the tiniest of leaks are more important than once thought and that you cannot afford to “Put in a bigger pump so you don’t have to worry about a few leaks, nor bother looking for them.” You’re kidding yourself if you believe that. More sap is the true test of your system, not high gauge readings. Your pipeline must be as tight as possible to increase sap yields significantly and avoid pumping air across the bush all season long. Waiting for the right breeze would make more sense and be a whole lot cheaper.
Finding Leaks–A Simple Solution
The obvious patiently waits to be stumbled upon by the weary. We stumbled on this technique while doing a tube washing experiment. We found that it doesn’t pay to suck on your pipeline while trying to find vacuum leaks, it’s better to pressurize it! Fill your network with sap, or better yet water before the season starts, and maintain the liquid at a steady 20 PSI with a pump. Then go for a walk throughout the bush looking for the easily seen “fountains” that stream from every leak point. It’s much easier to see these fountains than it is to hear the nearly inaudible hisses that develop under vacuum, especially on windy days. You’ll be absolutely amazed at how leak tight you thought your system was before you left. Nearly all leaks can be found this way, large and small, with perhaps hollow trees being an exception. We’ve found a couple of dozen sources of leaks during our travels but that is the basis for another article.
Sapsucker owners can use this method by placing a pressure relief valve set at 20 PSI in the vacuum mainline on a tee and attaching it to the pumps outlet tube end. Pumping sap, or water, into the network from the storage tank with a short pickup hose attached to the suction inlet tube end and routing the pressure relief valve overflow back to the storage tank completes the installation. At most a ten minute job. Turn on the pump and go for your walk. Take a friend or two along, it will speed things up.
Closed system gravity users and producers using other types of vacuum systems can use this method by attaching a relief valve set at 20 PSI to most any type of water pump and installing it as described above.
Summary
This very simple straightforward method of pipeline leak detection can save producers countless hours and many start up frustrations that usually occur at a time when they can be least afforded. Most important of all though, better sap yields can be realized and that is what we all set out to achieve in the first place. How much more sap you get is the true test of any pipeline system, and unfortunately there’s no gauge available for that.
Vacuum Transfer System
Research
Maple Syrup Digest
Russell S. Walters, Research Forester, USDA Forest Service Northeastern Forest Experiment Station Burlington, Vermont 05402
Vol. 21, No. 2
July 1981
REF# 159
Installing a transfer tank in a vacuum sap collection system may increase sap yields if the vacuum pump is a long distance from the sugarbush. Vacuum loss due to friction inside a pipe increases with distance. The vacuum transfer system reduces such loss. During two maple sap flow seasons in northern Vermont, larger volumes of sap were collected from a pipeline with a vacuum transfer tank than from a similar pipeline without a transfer tank. The pipeline with the transfer tank maintained higher vacuum levels at the taphole.
What we did
We conducted this study in a typical even-aged sugarbush in northern Vermont. The trees ranged from 16 to 28 inches in diameter. In 1973, we tapped 111 study trees and the next year 135. Three tapholes were drilled in each tree in late February of both years.
Each of the three tapholes per tree was connected to one of three parallel pipeline systems. The systems were identical except in the method by which sap was collected from them: gravity, vacuum pump, or vacuum pump with a transfer tank. The plastic pipelines were installed according to recommended procedures (Fig. 1).

Figure 1. The sap collection networks were constructed of 5/16 inch plastic tubing as unvented, aerial-line systems with droplines at least 18 inches long. The small lateral lines were connected to 1/2 inch main lines.
In the gravity system, the sap simply flowed downhill through the pipeline to the collection tank. The second pipeline was connected to a 40-gallon steel tank, where vacuum was created by a compressor-type vacuum pump. This tank was emptied by a water pump that was controlled by a float switch inside the tank (Fig. 2). The third system – the vacuum-transfer system (Fig. 3) differed from the vacuum system only in that a second tank was placed in the sugarbush (Fig. 4). Conduit lines from this tank branched out to different parts of the sugarbush. This system places the source of the vacuum closer to the trees. The slope from the transfer tank to the vacuum pump averaged about 6%. Two pipelines connected the transfer tank to the vacuum tank: the pipe at the bottom carried sap, while the one at the top evacuated gases, which created a vacuum.

Figure 2. Schematic of a sap collection vacuum tank. The float switch inside the tank automatically controls the water pump for sap removal.
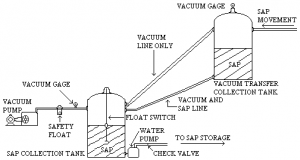
Figure 3. Schematic illustrates how the vacuum-transfer tank is connected to the sap collection vacuum tank.

Figure 4. The vacuum-transfer tank is in the sugarbush. Sap flows from the trees on the left into the tank. The upper pipe on the right removes air from the tank, creating a vacuum, and sap travels out through the lower pipe.
The pumps were controlled automatically by a thermostat so they would run when the air temperature was above 30°F. Vacuum gauges were installed on each vacuum tank, the transfer tank, and each pipeline at the point farthest from the vacuum pump.
Results
The volume of sap per taphole collected by the vacuum-transfer System during each season was greater than that collected by the other two systems (Table 1). In 1973, the amount collected by vacuum transfer was 27% more than was collected by vacuum only, and 109% more than was collected by gravity. The amount collected by vacuum alone was 65% more than was collected by gravity. All of these differences were statistically significant. In 1974, the transfer system yielded 17% more sap than vacuum alone; this difference was not significant. The transfer tank and the vacuum systems produced 29% and 23% more sap, respectively, than the gravity system. These differences were significant.
Table 1. Average sap volume per taphole collected by three tubing systems, 1973 and 1974, in gallons.

